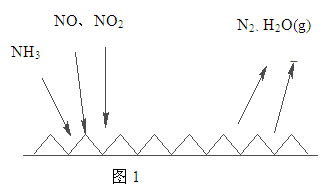
题目内容
下列变化中,需加入适当氧化剂才能完成的是
| A.CuO → Cu | B.KCl→AgCl | C.Fe→FeCl3 | D.HNO3 → NO |
C
解析试题分析:需要加氧化剂,那么说明下面的选项是做还原剂的,而还原剂是指化合价升高的,所以答案选C
考点:考查氧化还原反应的相关知识点

练习册系列答案
相关题目
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。淀粉KI溶液中通入SO2气体,溶液无明显变化。则下列分析中正确的是
| A.白色沉淀是CuI2,棕色溶液含有I2 |
| B.滴加KI溶液时,转移2mol e- 时生成1mol白色沉淀 |
| C.通入SO2时,SO2与I—反应,I—作还原剂 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
已知:还原性强弱:I― >Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
| A.1.1mol·L-1 | B.1.5mol·L-1 | C.1.2mol·L-1 | D.1.0mol·L-1 |
对于反应:3S+6NaOH=2Na2S+Na2SO3+3H2O, 以下说法正确的是( )
| A.该反应既属于四种基本类型的反应,又属于氧化还原反应 |
| B.氧元素被还原,硫元素被氧化 |
| C.每有3 mol S参加反应转移6 mol电子 |
| D.S既是氧化剂又是还原剂 |
从海水提取溴的过程中,有如下反应: 5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O,与上述反应原理最相似的反应是 ( )
| A.2NaBr+Cl2===Br2+2NaCl |
| B.AlCl3+3NaAlO2+6H2O===4Al(OH)3↓+3NaCl |
| C.2H2S+SO2===3S↓+2H2O |
| D.Cl2+H2O===HCl+HclO |
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转化为铜蓝(CuS)。下列分析正确的是
| A.CuS的溶解度大于PbS的溶解度,Ksp(ZnS)<Ksp(CuS) |
| B.原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| C.CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓ |
| D.整个过程涉及的反应类型有氧化还原反应和复分解反应 |
下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是
| A.F2、K、HCl | B.Cl2、Al、H2 |
| C.SO2、Na、Br2 | D.O2、SO2、H2O |