题目内容
【题目】I、钢铁中加入少量镍铬等元素可制成不锈钢,东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是______________________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为_________,提供孤电子对的成键原子是________。
(2)铁元素有变价,试根据原子核外电子排布所遵循的原理解释Fe2+具有较强的还原性,易被氧化为Fe3+的原因______________________________。
(3)普鲁士蓝(Prussian Blue),即亚铁氰化铁,化学式Fe4[Fe(CN)6]3是一种配合物,其中含有的化学键有____________________;
a.共价键 b.离子键 c.配位键 d.金属键 e.氢键
II、钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为2Mn2++5S2O82+8H2O=2MnO4+10SO42+16H+
(4)写出基态锰原子的价电子排布的轨道表示式:________________。
(5)已知H2S2O8的结构如图:
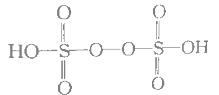
①H2S2O8硫原子的轨道杂化方式为________________。
②上述反应每生成2 mol MnO4,S2O82断裂的共价键数目为_________。
③上述反应中被还原的元素为________________。
【答案】正四面体型 配位键 N Fe2+的价电子排布式为 3d6 ,3d轨道再失去一个电子后就成了半充满的结构,根据洪特规则,这种结构能量较低,较稳定,所以Fe2+容易失去一个电子,易被氧化为Fe3+ (答到半充满的结构,较稳定算对)。 abc 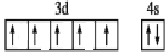 sp3杂化 5NA S
sp3杂化 5NA S
【解析】
(1)①根据价层电子对互斥理论分析SO42-的空间构型。
②[Ni(NH3)6]2+为一种配离子,Ni2+与NH3之间以配位键成键,NH3中的N原子提供孤电子对。
(2)根据Fe2+的价电子排布式为3d6分析解答。
(3)Fe4[Fe(CN)6]3是一种配合物,根据配合物的结构特点可知,该配合物中含有共价键、配位键、离子键。
(4)根据Mn的原子序数为25来解答。
(5)①H2S2O8中S原子形成4个σ键,S上无孤电子对,S的价层电子对数为4,采取sp3杂化。
②由反应可知,则每生成2mol MnO4,消耗S2O82为5mol,反应中S2O82中过氧键发生断裂生成SO42,故S2O82断裂的共价键数目为5NA。
③由反应可知,Mn元素的化合价升高(+2→+7),S元素的化合价降低(+7→+6),被还原的元素为S。
(1)①SO42-中的中心原子S的价层电子对数为4+![]() ×(6+2-4×2)=4,S上没有孤电子对,SO42-的空间构型为正四面体型,故答案为:正四面体型。
×(6+2-4×2)=4,S上没有孤电子对,SO42-的空间构型为正四面体型,故答案为:正四面体型。
②[Ni(NH3)6]2+为一种配离子,Ni2+与NH3之间以配位键成键,NH3中的N原子提供孤电子对,故答案为:配位键; N。
(2)Fe2+的价电子排布式为3d6 ,3d轨道再失去一个电子后就成了半充满的结构,根据洪特规则,这种结构能量较低,较稳定,所以Fe2+容易失去一个电子,易被氧化为Fe3+,故答案为:Fe2+的价电子排布式为3d6 ,3d轨道再失去一个电子后就成了半充满的结构,根据洪特规则,这种结构能量较低,较稳定,所以Fe2+容易失去一个电子,易被氧化为Fe3+。
(3)Fe4[Fe(CN)6]3是一种配合物,根据配合物的结构特点可知,Fe3+与[Fe(CN)6]4-间为离子键,[Fe(CN)6]4-内Fe2+与CN-间为配位键,CN-内含共价键,故选abc。
(4)Mn的原子序数为25,基态锰原子的价电子排布的轨道表示式: ,故答案为:
,故答案为: 。
。
(5)①H2S2O8中S原子形成4个σ键,S上无孤电子对,S的价层电子对数为4,采取sp3杂化。故答案为:sp3杂化。
②由反应可知,则每生成2mol MnO4,消耗S2O82为5mol,反应中S2O82中过氧键发生断裂生成SO42,故S2O82断裂的共价键数目为5NA,故答案为:5NA。
③由反应可知,Mn元素的化合价升高(+2→+7),S元素的化合价降低(+7→+6),被还原的元素为S,故答案为:S。

 阅读快车系列答案
阅读快车系列答案