题目内容
已知:H2(g)+
O2(g)=H2O(l)△H=-285.8kJ?mol-1;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ?mol-1
现有H2和CH4的混合气体112L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5kJ,则原混合气体中H2和CH4的物质的量之比是( )
| 1 |
| 2 |
现有H2和CH4的混合气体112L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5kJ,则原混合气体中H2和CH4的物质的量之比是( )
| A.1:1 | B.1:3 | C.1:4 | D.2:3 |
H2和CH4的混合气体112L(标准状况)物质的量为
=5mol,
所以混合气体的平均燃烧热为为
kJ/mol=648.5kJ/mol,
由H2(g)+
O2(g)=H2O(1)△H=-285.8kJ?mol-1可知,氢气的燃烧热为285.8kJ/mol;
由CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-890.3kJ?mol-1可知,甲烷的燃烧热为890.3kJ/mol.
根据十字交叉法计算原混合气体中H2和CH4的物质的量之比:
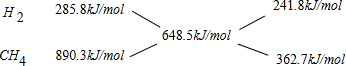
所以原混合气体中H2和CH4的物质的量之比为241.8kJ/mol:362.7kJ/mol=2:3.
故选:D.
| 112L |
| 22.4L/mol |
所以混合气体的平均燃烧热为为
| 3242.5 |
| 5 |
由H2(g)+
| 1 |
| 2 |
由CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-890.3kJ?mol-1可知,甲烷的燃烧热为890.3kJ/mol.
根据十字交叉法计算原混合气体中H2和CH4的物质的量之比:

所以原混合气体中H2和CH4的物质的量之比为241.8kJ/mol:362.7kJ/mol=2:3.
故选:D.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案
相关题目
已知:H2(g)+1/2O2(g)=H2O(l) △H =-285.83kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H =-282.9kJ/mol
若氢气与一氧化碳的混合气体完全燃烧可生成5.4克水(l),并放出114.3kJ的热量,则混合气中一氧化碳的物质的量为( )
|
A.0.22 mol |
B.0.15 mol |
|
C.0.1 mol |
D.0.05 mol |

