题目内容
【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
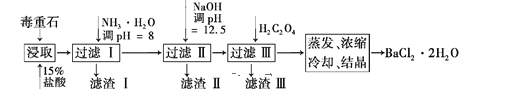
(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而_____________。
(2) 加入NH3·H2O调节pH=8可除去____(填离子符号),此时,溶液中该离子的浓度为______mol·L-1。再加入NaOH调pH=12.5,溶液内剩余的阳离子中______完全沉淀,____部分沉淀 (填离子符号)。加入H2C2O4时应避免过量,原因是____。已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9, Ksp[Fe(OH)3] =2.6×10-39。

(3由于Na2S2O5具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中Na2S2O5的残留量时,取40mL葡萄酒样品于锥形瓶中,滴入几滴淀粉溶液,用0.02 mol·L-1碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为__________,Na2S2O5的含量是以SO2来计算的,则该样品中Na2S2O5的残留量以![]() 计为______
计为______![]() 。
。
【答案】使反应速率加快 Fe3+ 2.6×10-21 Mg2+ Ca2+ H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少 滴定终点的现象为最后一滴碘标准液滴入后溶液恰好由无色变为蓝色,且半分钟内不褪色 0.16g/L
【解析】
(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积,加快反应速率;
(2) 从表中数据看,加入NH3·H2O调节pH=8时,只有Fe3+全部生成沉淀;此时,溶液中Fe3+离子的浓度为可利用Ksp[Fe(OH)3] =2.6×10-39进行计算。再加入NaOH调pH=12.5,溶液内剩余的阳离子中Mg2+完全沉淀;Ca2+部分沉淀。由Ksp(BaC2O4)=1.6×10-7知,加入H2C2O4时若过量会生成BaC2O4沉淀;
(3)起初加入0.02 mol·L-1碘的标准溶液时,被还原为I-,所以溶液呈无色,当达滴定终点时,溶液中存在I2,溶液开始变蓝,所以达滴定终点时,溶液由无色变为蓝色,且在半分钟内不变色;n(SO2)=n(I2)= 0.02 mol·L-1×0.005L=1×10-4mol,则该样品中Na2S2O5的残留量以![]() 计为
计为![]() g/L。
g/L。
(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积,加快反应速率;答案为:使反应速率加快;
(2) 从表中数据看,加入NH3·H2O调节pH=8时,c(OH-)=10-6mol/L,只有Fe3+全部生成沉淀,溶液中Fe3+的浓度为![]() mol/L;再加入NaOH调pH=12.5,由表中数据可知,溶液内剩余的阳离子中Mg2+完全沉淀;Ca2+部分沉淀。由Ksp(BaC2O4)
mol/L;再加入NaOH调pH=12.5,由表中数据可知,溶液内剩余的阳离子中Mg2+完全沉淀;Ca2+部分沉淀。由Ksp(BaC2O4)
=1.6×10-7知,加入H2C2O4时若过量会生成BaC2O4沉淀;答案为:2.6×10-21;Mg2+;Ca2+;H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少;
(3)起初加入0.02 mol·L-1碘的标准溶液时,被还原为I-,所以溶液呈无色,当达滴定终点时,溶液中存在I2,溶液开始变蓝,所以达滴定终点时,溶液由无色变为蓝色,且在半分钟内不变色;n(SO2)=n(I2)= 0.02 mol·L-1×0.005L=1×10-4mol,则该样品中Na2S2O5的残留量以![]() 计为
计为![]() g/L;答案为:0.16。
g/L;答案为:0.16。

 小学教材完全解读系列答案
小学教材完全解读系列答案