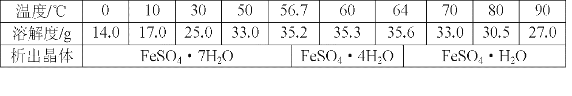
题目内容
【题目】某电化学气敏传感器的工作原理如图所示,下列说法不正确的是

A. a极为负极
B. b极的电极反应式为O2+4e-+2H2O=4OH-
C. 电子流向:a经外电路流向b
D. 该传感器工作一段时间后,电解质溶液的pH值将变大
【答案】D
【解析】
根据图示可知b电极是氧气获得电子,发生还原反应,所以b极为正极,因为电解质溶液为KOH,所以电极反应为:O2+4e-+2H2O=4OH-,a电极是氨气失去电子,发生氧化反应,所以a极为负极。
A、根据上述分析可知,a电极是氨气失去电子,发生氧化反应,所以a极为负极,故A正确;
B、是氧气获得电子,发生还原反应,所以b极为正极,因为电解质溶液为KOH,所以电极反应为:O2+4e-+2H2O=4OH-,故B正确;
C、a极为负极电子流出,经外接导线,流向b电极(正极),故C正确;
D.总反应方程式是:4NH3+ 3O2=2N2+6H2O,可见KOH没有参加反应,故该传感器在工作过程中KOH的物质的量不变,所以电解质溶液pH值不变,故D错误;
综上所述,本题正确答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】下述实验不能达到预期实验目的的是
序号 | 实验内容 | 实验目的 |
A. | 将2.5g CuSO4·5H2O溶解在97.5g 水中 | 配制质量分数为1.6%的CuSO4溶液 |
B. | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
C. | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种更难溶的沉淀 |
D. | 分别向2支试管中加入5mL4%、5mL12%的过氧化氢溶液,再各加入几滴0.2mol·L-1FeCl3溶液 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。

(1)Fe还原水体中NO3-的反应原理如图1所示。
①作负极的物质化学式为___________。
②正极的电极反应式是_________________________________________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_____________________________________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图2所示,可得到的结论是____________________。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________,解释加入Fe2+提高NO3-去除率的原因:_____________________________________。