题目内容
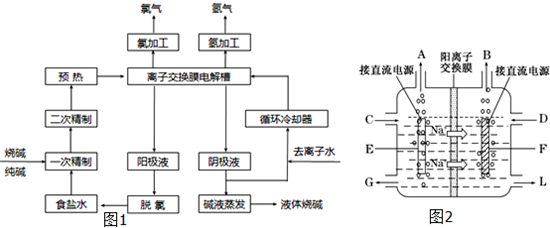
氯碱工业中电解饱和食盐水的原理示意图如图所示:

(1)溶液A的溶质是____________;
(2)电解饱和食盐水的离子方程式是________ ;
(3)电解时用盐酸控制阳极区溶液的PH在2~3,用化学平衡移动原理解释盐酸的作用____________ ;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。精致流程如下:
(2)电解饱和食盐水的离子方程式是________ ;
(3)电解时用盐酸控制阳极区溶液的PH在2~3,用化学平衡移动原理解释盐酸的作用____________ ;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。精致流程如下:

①盐泥a除泥沙外,还含有的物质是_____________。
②过程Ⅰ中将NH4+转化为N2的离子方程式是___________________
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有_________________
④经过程Ⅲ处理,要求盐水中c 中剩余Na2SO3的含量小于5mg /L,若盐水b中NaClO的含量是7.45 mg /L ,则处理10m3 盐水b ,至多添加10% Na2SO3溶液_________ kg(溶液体积变化忽略不计)。
②过程Ⅰ中将NH4+转化为N2的离子方程式是___________________
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有_________________
④经过程Ⅲ处理,要求盐水中c 中剩余Na2SO3的含量小于5mg /L,若盐水b中NaClO的含量是7.45 mg /L ,则处理10m3 盐水b ,至多添加10% Na2SO3溶液_________ kg(溶液体积变化忽略不计)。
(1)NaOH
(2)2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(3)氯气与水反应:Cl2+H2O HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出
HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出
(4)①Mg(OH)2; ②2NH4++3Cl2+8OH-=8H2O+6Cl-+N2↑;③SO42-、Ca2+;④1.76
(2)2Cl-+2H2O
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑(3)氯气与水反应:Cl2+H2O
 HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出
HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出(4)①Mg(OH)2; ②2NH4++3Cl2+8OH-=8H2O+6Cl-+N2↑;③SO42-、Ca2+;④1.76

练习册系列答案
相关题目
化学工业在经济发展中的作用举足轻重,下列有关工业生产的叙述中,正确的是( )
| A、硫酸生产中常采用高压条件提高SO2的转化率 | B、合成氨中采用及时分离氨气提高反应速率 | C、电解精炼铜时,溶液中c(Cu2+)基本保持不变 | D、氯碱工业电解饱和食盐水时,阳极得到氢氧化钠和氢气 |
下列不正确的是( )
| A、用电解法精练粗铜时,粗铜作阳极,纯铜作阴极 | B、锌锰干电池工作时,电池的总反应为:Zn+2MnO2+2NH4+?Zn2++Mn2O3+2NH3+H2O | C、钢铁电化学腐蚀时,负极反应式为:2H2O+O2+4e-?4OH- | D、氯碱工业中电解饱和食盐水,阳极反应式为:2Cl--2e-?Cl2 |
下列关于“氯碱工业”的说法中,正确的是( )
| A、“氯碱工业”的原料是Cl2和烧碱 | B、“氯碱工业”的主要生产过程是电解饱和食盐水 | C、“氯碱工业”的主要产品是纯碱 | D、“氯碱工业”消耗的能源主要是热能 |