题目内容
19.下列对有关元素的叙述能说明该元素一定是主族元素的是( )| A. | N层比M层少8个电子的元素 | B. | L层比M层多一个电子的元素 | ||
| C. | 最高价为+6价的元素 | D. | 无负化合价的元素 |
分析 A.N层比M层少8个电子的元素为Ti元素;
B.原子核外L层比M层多一个电子的元素,该元素为Cl;
C.最高价为+6价的元素有氧族元素及一些过渡元素,如Cr等;
D.无负化合价的元素为金属元素.
解答 解:A.N层比M层少8个电子的元素为Ti元素,为ⅣB元素,故A错误;
B.原子核外L层比M层多一个电子的元素,该元素为Cl,处于第三周期ⅦA族,故B正确;
C.最高价为+6价的元素有氧族元素及一些过渡元素,如Cr等,故C错误;
D.无负化合价的元素为金属元素,可为过渡金属元素,故D错误.
故选B.
点评 本题考查元素周期表结构及应用,根据外围电子排布确定元素在周期表中族问题,注意外围电子与最外层电子不同,难度不大.

练习册系列答案
相关题目
9.短周期元素X、Y、Z、W的原子序数依次增大,X-与Y2+电子层结构与Ne原子的电子层结构相同,Z单质是金属,W的最外层电子数是内层电子总数的一半,下列正确的是( )
| A. | 原子半径r(X)<r(Y),离子半径r(X-)>r(Y2+) | |
| B. | X的简单气态氢化物的稳定性比W的弱 | |
| C. | X分别与Y、W形成的化合物中化学键类型相同 | |
| D. | Z是活泼的金属,其最高价氧化物对应的水合物为强碱 |
10.在高温高压的水溶液中,AuS-与Fe2+发生反应沉积出磁铁矿(主要成分Fe3O4)和金矿(含Au),并伴有H2S气体生成.对于该反应的说法一定正确的是( )
| A. | 氧化剂和还原剂的物质的量之比2:3 | |
| B. | AuS-既作氧化剂又作还原剂 | |
| C. | 每生成2.24 L气体,转移电子数为0.1mol | |
| D. | 反应后溶液的pH值降低 |
7.下列说法不正确的是( )
| A. | 常温下,将CH3COONa溶液,盐酸混合后,溶液呈中性,则有c(Cl-)=c(CH3COOH) | |
| B. | 常温下将pH=2的硫酸和pH=12的氨水等体积混合,所得溶液的pH>7 | |
| C. | pH=3的醋酸溶液加水稀释后,溶液中c(CH3COO-)•c(H+)不变 | |
| D. | 向0.1 mol•L-1的Na2SO3溶液中加入少量NaOH固体,c(SO32-)与c(Na+)均增大 |
14.在一定温度下,将足量的AgCl固体分别加入①10mL蒸馏水②30mL0.1mol•L-1NaCl溶液;③5ml 0.5 mol•L-1NaCl溶液; ④10ml 0.2 mol•L-1HCl溶液中.使AgCl溶解并达到饱和,各溶液中Ag+浓度由大到小排列的正确顺序是 ( )
| A. | ④>②>③>① | B. | ①>②>③>④ | C. | ①>②>④>③ | D. | ①>③>②>④ |
4.下列有关六方最密堆积与面心立方最密堆积的说法中正确的是( )
| A. | 六方最密堆积是最密堆积,面心立方最密堆积不是最密堆积 | |
| B. | 两者都是最密堆积,其中六方最密堆积是一、三、五…各层球心重合,二、四、六…各层球心重合;面心立方最密堆积是四、五、六…层分别和一、二、三…球心重合 | |
| C. | 原子晶体一般都采用六方最密堆积或面心立方最密堆积 | |
| D. | 只有金属晶体才可能采用六方最密堆积或面心立方最密堆积 |
11.已知某有机物A的结构简式如下:
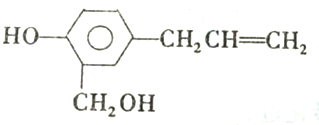 对该物质的性质判断正确的是( )
对该物质的性质判断正确的是( )
 对该物质的性质判断正确的是( )
对该物质的性质判断正确的是( )| A. | 等量A分别与Na和NaOH反应消耗二者的物质的量相同 | |
| B. | 1 mol A 可与2 mol Br2发生取代反应 | |
| C. | A与Na2CO3反应可放出CO2 | |
| D. | 1 mol A 可与4 mol H2发生反应 |