题目内容
5.某强酸性(含H+)溶液X,可能含有Al3+、Ba2+、NH+4、Fe2+、Fe3+、CO2-3、SO2-4、SiO2-3、NO-3中的一种或几种离子,取该溶液进行连续实验,其现象及转化如图.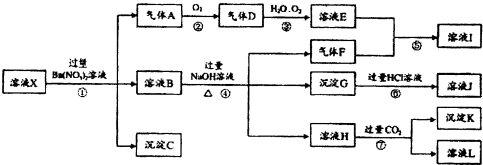
请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有CO32-、SiO32-;
(2)产生气体A的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)溶液X中关于NO-3的判断正确的是b.
a.一定有 b.一定没有 c.可能有
(4)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为4:1;
(5)生成气体F的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
产生沉淀K的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
(6)通过以上实验不能确定是否存在的离子是Fe3+,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断是否存在,该试剂最好是②.
①氯水②KSCN溶液③石蕊试剂④pH试纸⑤KMnO4溶液⑥氯水和KSCN混合溶液.
分析 强酸性溶液中一定不会存在CO32-和SiO32-离子;加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子;溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子;溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+,以此来解答.
解答 解:强酸性溶液中一定不会存在CO32-和SiO32-离子;加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子;溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子;溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子;溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+,
(1)强酸性溶液中一定不会存在CO32-和SiO32-离子;
故答案为:CO32-、SiO32-;
(2)酸性条件下,亚铁离子与硝酸根离子反应生成NO和三价铁离子,则反应①生成A的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)由分析可知,溶液中含有Fe2+离子,酸性条件下,一定不含NO3-离子;
故答案为:b;
(4)NO2、H2O、O2三种物质恰好发生化合反应生成HNO3,其反应方程式为:4NO2+2H2O+O2=4HNO3,则反应中NO2与O2的物质的量之比为4:1;
故答案为:4:1;
(5)氢氧根离子和铵根离子反应生成氨气,其反应离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;通入过量二氧化碳后发生的反应为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(6)不能确定是否含有的离子Fe3+,若要检验铁离子,取原溶液少量于试管中,滴加KSCN溶液,若变红,则证明存在Fe3+;
故答案为:Fe3+;②.
点评 本题考查了常见阴阳离子的检验、无机推断,题目难度中等,注意掌握常见离子的性质及检验方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

| 实验方案 |
| 1.用砂纸打磨后的镁带加适量水加热,再向反应后溶液中滴加酚酞 |
| 2.钠与滴有酚酞试液的冷水反应 |
| 3.镁带与2mol/L的盐酸反应 |
| 4.铝条与2mol/L的盐酸反应 |
| 5.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
| 实验现象 |
| (A) |
| (B)反应不十分强烈,产生气体 |
| (C)剧烈反应,产生气体 |
| (D)生成白色胶状沉淀,然后沉淀消失 |
| (E)产生的气体可在空气中燃烧,溶液变成浅红色 |
(1)实验的目的探究同周期元素金属性的递变规律.
(2)实验仪器:①试管②酒精灯③胶头滴管④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:
与实验方案1至5对应的实验现象依次为E、A、C、B、D(填字母编号).实验现象(A)为:钠浮在水面上,熔化化成小球,四处游动,发出嘶嘶响声,溶液变红.
(4)实验结论同周期元素从左到右金属性减弱.
已知:SO32-+Cl2+H2O═SO42-+2Cl-+2H+;2Fe3++2I-═2Fe2++I2
根据上述实验,以下推测正确的是( )
| A. | 原溶液一定存在NH4+、I- | |
| B. | 原溶液一定不含Ba2+、Fe3+、I- | |
| C. | 原溶液可能存在K+、Fe3+、SO42- | |
| D. | 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液所有的离子组成 |
| A. | 建造三峡大坝使用了大量水泥,水泥属于硅酸盐材料 | |
| B. | 人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 金属冶炼的本质是金属阳离子得到电子变成金属原子 |
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表:(表中不要留空格)
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
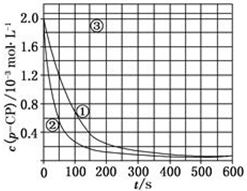 [数据处理]实验测得p-CP的浓度随时间变化的关系如图:
[数据处理]实验测得p-CP的浓度随时间变化的关系如图:(2)请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1;
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解;
(4)实验③得出的结论是:pH等于10时,反应不能(填“能”或“不能”)进行;
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.

 .
. +Br2→
+Br2→ .
. .
.
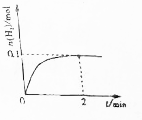 一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol
一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol