题目内容
【题目】Ⅰ、现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨漏斗;⑩胶头滴管。有下列药品:①NaOH固体;②0.1000mol/L的标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液;⑤蒸馏水。试回答以下问题。
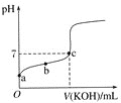
(1)做酸碱中和滴定时,还缺少的试剂是____;
(2)配制250mL0.1000mol/LNaOH溶液时,还缺少的仪器是____;
(3)过滤时,应选用上述玻璃仪器中的____(填编号)。
Ⅱ、为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在___(填“酸式或碱式滴定管”)中,达到滴定终点的现象为____。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度___(填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为__mol/L。
【答案】指示剂 250mL容量瓶 ④⑤⑨ 酸式滴定管 当滴加最后一滴KMnO4溶液时,锥形瓶中溶液从无色变为浅紫色,且半分钟内不变色 偏高 0.1c(b-a)
【解析】
I.(1)做酸碱中和滴定时,还缺少的试剂是酸碱指示剂,来判断反应是否达到滴定终点;
(2)配制250mL0.1000mol/LNaOH溶液时,还缺少的仪器是用于配制溶液的250mL的容量瓶;
(3)过滤操作,应当用漏斗组装成过滤器,用玻璃棒引流,用烧杯盛装液体,故应当选④⑤⑨;
II.(1)因为高锰酸钾是强氧化性物质,故应当使用酸式滴定管,该实验操作为使用高锰酸钾滴定草酸,故当滴加最后一滴KMnO4溶液时,锥形瓶中溶液从无色变为浅紫色,且半分钟内不变色,达到滴定终点;
(2)若滴定时,没用标准液洗涤滴定管,标准液浓度偏小,造成V(标准)偏大,根据c(待测) ![]() 分析,c(待测)偏高;
分析,c(待测)偏高;
(3)若滴定时,反应前后的两次读数分别为a和b,消耗的![]() 标准溶液体积为
标准溶液体积为![]() ,
,
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
2 5
![]()
![]()
计算得出:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1mol/L的4种钠盐溶液pH如表:
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中,正确的是( )
A. 向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B. 四种溶液中,水的电离程度最大的是NaClO
C. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D. NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)