题目内容
19.某有机物燃烧产生等体积的二氧化碳和水蒸气,0.1mol该有机物燃烧时需0.5mol氧气,将产生的二氧化碳和水蒸气通过碱石灰充分吸收后,碱石灰增重24.8g.请完成下列问题
(1)该有机物中C,H原子个数比为1:2
(2)该有机物的分子式C4H8O2
(3)若该有机物能与NaHCO3溶液反应产生气体,则符合该有机物的结构有2种.
分析 (1)有机物燃烧产生等体积的二氧化碳和水蒸气,则二氧化碳与水的物质的量相等,根据原子守恒可知C、H原子数目之比;
(2)碱石灰增重24.8g为燃烧生成的二氧化碳与水,计算二者物质的量,根据原子守恒计算C、H原子数目,根据质量守恒计算有机物的质量,进而计算其相对分子质量,根据相对分子质量计算分子中氧原子数目,确定有机物分子式;
(3)该有机物能与NaHCO3溶液反应产生气体,说明含有-COOH,结合分子式书写可能的结构简式.
解答 解:(1)有机物燃烧产生等体积的二氧化碳和水蒸气,则CO2与H2O的物质的量相等,根据原子守恒可知C、H原子数目之比为1:2,故答案为:1:2;
(2)碱石灰增重24.8g为燃烧生成的二氧化碳与水,故二者物质的量为$\frac{24.8g}{44g/mol+18g/mol}$=0.4mol,根据原子守恒可知N(C)=$\frac{0.4mol}{0.1mol}$=4、N(H)=$\frac{0.4mol×2}{0.1mol}$=8,有机物的质量为24.8g-32g/mol×0.5mol=8.8g,有机物的相对分子质量为$\frac{8.8}{0.1}$=88,故有机物分子中氧原子数目为$\frac{88-12×4-8}{16}$=2,故有机物A的分子式为C4H8O2,故答案为:C4H8O2;
(3)该有机物能与NaHCO3溶液反应产生气体,说明含有-COOH,可能的结构简式有:CH3CH2CH2COOH、(CH3)2CHCOOH,共有2种,故答案为:2.
点评 本题考查有机物分子式的确定,难度不大,掌握燃烧法利用原子守恒计算确定有机物分子式.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
9.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见右表.回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内.
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为 11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.已知:3Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-.则溶液中铁元素的总含量为5.6g•L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”).

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见右表.回答下列问题:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为 11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.已知:3Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-.则溶液中铁元素的总含量为5.6g•L-1.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”).
10.下列说法正确的是( )
| A. | 乙烯能与高锰酸钾发生取代反应而使酸性高锰酸钾溶液褪色 | |
| B. | 苯能与高锰酸钾发生取代反应而使酸性高锰酸钾溶液褪色 | |
| C. | 乙烯能与溴单质发生加成反应而使溴水褪色 | |
| D. | 苯能与溴单质发生加成反应而使溴水褪色 |
7.油脂在NaOH稀溶液中发生皂化反应,可以判断反应基本完成的现象是( )
| A. | 反应液使酚酞试液变红色 | B. | 反应液使蓝色石蕊试纸变红色 | ||
| C. | 有大量固体析出 | D. | 反应后静置,反应液不分层 |
14.利用下列实验装置进行的相应实验,能达到实验目的是(部分夹持仪器未画出)( )
| A. |  分离乙醇和乙酸乙酯 | |
| B. |  分离苯和甲苯 | |
| C. |  实验室制备,收集乙烯并验证其易被氧化 | |
| D. |  实验室制取乙酸乙酯 |
4.结构为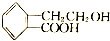 的有机物可以通过不同的反应得到下列五种物质
的有机物可以通过不同的反应得到下列五种物质
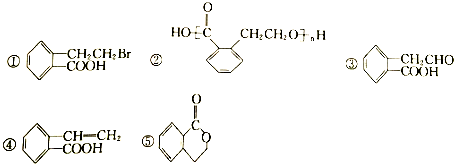
生成这五种有机物的反应类型依次为( )
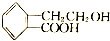 的有机物可以通过不同的反应得到下列五种物质
的有机物可以通过不同的反应得到下列五种物质
生成这五种有机物的反应类型依次为( )
| A. | 取代、加成、氧化、消去、取代 | B. | 取代、取代、还原、消去、酯化 | ||
| C. | 酯化、缩聚、取代、消去、取代 | D. | 取代、缩聚、氧化、消去、酯化 |
11.某水溶液只可能含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、CO32-和SO42-.现取三份100mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH溶液后加热,收集到标准状况下的气体896mL;
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g.
根据上述实验事实,以下推测不正确的是( )
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH溶液后加热,收集到标准状况下的气体896mL;
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g.
根据上述实验事实,以下推测不正确的是( )
| A. | 不-定存在K+ | B. | 100mL溶液中含有0.02molCO32- | ||
| C. | 可能存在Cl- | D. | 一定不存在Mg2+ |
8.人体缺铁会引起下列哪种疾病( )
| A. | 大脖了病 | B. | 糖尿病 | C. | 痛痛病 | D. | 贫血症 |
9.已知非金属单质A2、B2、C2之间能发生如下反应:A2+2B-=2A-+B2,B2+2C-=2B-+C2.以下说法正确的是( )
| A. | 氧化性:A2>B2>C2 | B. | 还原性:A->B->C- | ||
| C. | 单质活动性:C2>B2>A2 | D. | 反应:A2+2C-=2A-+C2不能发生 |