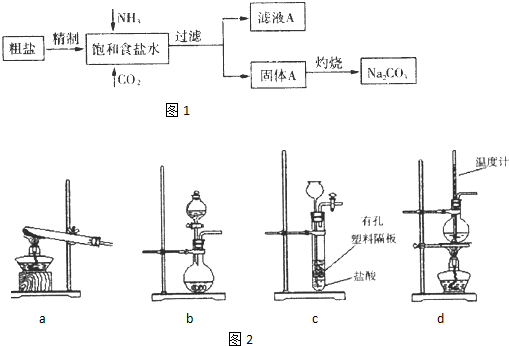
题目内容
( 13分)实验室中需要22.4 l(标准状况)SO2气体。化学小组同学依据化学方程式Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(
ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(![]() )110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
)110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是
(用化学方程式和必要的文字加以说明)
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。

①装置B中加入的试剂 ,作用是 。
②装置D加入的试剂 ,装置F加入的试剂 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是 。
④U型管G的作用为 .
(13分)
(1)(4分)H2(2分);随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2
Zn+H2SO4===ZnSO4+H2↑(2分)
(2)(9分)
①NaOH溶液(或KMnO4,其它合理答案也给分,1分)
除去混合气体中的SO2。(2分)
②浓硫酸(1分) 无水硫酸铜(1分)
③装置E中玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色(2分)
④防止空气中H2O进入干燥管而影响杂质气体的检验(2分)
解析:

(13分)X、Y、Z、W为常见含有相同电子数的离子或分子,其中X微粒含有5个原子核,这些微粒与一氧化氮间有如下转化关系(图中部分反应物、产物及反应条件已略去)。
(1)Z →NO反应的化学方程式是:
液态 Z的电离与水的电离相似,电离生成电子数相同的两种微粒,写出液态Z的电离方程式 。
(2)实验室中检验Z的化学试剂及现象是:
|
| 化学试剂 | 现象 |
| 方法一 |
|
|
| 方法二 |
|
|
(3)由构成X、Y的三种元素所组成的一种离子化合物,且三种元素原子数之比为2︰4︰3,该离子化合物是 (填写化学式),其0.1mol/L的该溶液显酸性,则该溶液中离子浓度由大到小的顺序为 。
(4)一定条件下,Z与一氧化氮或二氧化氮反应均可生成两种很稳定的产物。若有二氧化氮与Z的混合气体20mL在该条件下反应,实际参加反应的二氧化氮比Z少2 mL,则原混合气两者的体积比是:
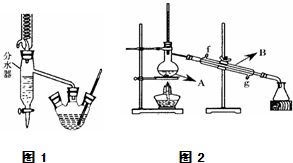 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表. ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(
ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4( )110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
)110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。