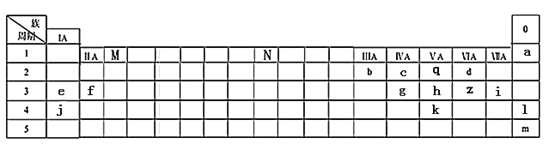
题目内容
【题目】含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O![]() 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
![]()
(1)绿矾化学式为FeSO4·7H2O。反应(I)的离子方程式为__。
(2)若处理后的废水中c(Cr3+)=3.0×10-6mol/L,则废水中c(Fe3+)=__mol/L。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
【答案】14H++Cr2O![]() +6Fe2+=2Cr3++6Fe3++7H2O 2×10-13
+6Fe2+=2Cr3++6Fe3++7H2O 2×10-13
【解析】
反应(I)为氧化还原反应,利用化合价升降法进行配平;利用溶度积进行计算;
(1)根据流程,Cr2O![]() 将Fe2+氧化成Fe3+,本身被还原为Cr3+,因为是酸性环境,因此反应(I)的离子方程式为
将Fe2+氧化成Fe3+,本身被还原为Cr3+,因为是酸性环境,因此反应(I)的离子方程式为![]() ;
;
(2)处理后的废水中存在:![]() ,代入数值,得到
,代入数值,得到![]() ,解得c(Fe3+)=2×10-31mol·L-1。
,解得c(Fe3+)=2×10-31mol·L-1。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目