题目内容
海水制盐后的盐卤加热到363K,调节pH为3.5,通入Cl2把Br2置换出来.然后用热空气把Br2吹出,以Na2CO3溶液吸收,最后用H2SO4酸化,单质Br2又可从溶液中析出.写出有关反应的化学方程式.
答案:
解析:
提示:
解析:
|
【解答】2NaBr+Cl2=2NaCl+Br2 3Na2CO3+3Br2=5NaBr+NaBrO3+3CO2↑ (Na2CO3+CO2+H2O=2NaHCO3) 5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O 【巧解导析】这道题涉及到溴元素的“浓缩”问题,盐卤中溴元素的含量不高,但可和氯水中的Cl2发生置换反应,但得到的溴水浓度很低,甚至低于使用萃取剂萃取出来的浓度要求;但可利用Br2的挥发性,用热空气吹出后再用廉价的纯碱溶液吸收(HBr和HBrO3的酸性都比H2CO3的酸性强得多),Br元素就在Na2CO3溶液中富集了,然后用H2SO4酸化, |
提示:
|
抓住一条主线思考: 另外,还要弄清楚如下两个问题: (1)在碱性条件下有利于X2(F2除外)的歧化反应;在强酸性条件下有利于“归中反应”,即有利于X2单质的生成. (2)X2的单质在热碱性溶液中歧化成X-和 |

练习册系列答案
相关题目
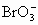 和Br-在H+存在时发生“归中反应”重新生成了较浓的Br2,再来通过萃取等后续操作得到纯Br2.
和Br-在H+存在时发生“归中反应”重新生成了较浓的Br2,再来通过萃取等后续操作得到纯Br2.
 ,在较低温度时的歧化产物为X-和XO-.
,在较低温度时的歧化产物为X-和XO-.