题目内容
某化学兴趣小组制取并进行乙烯性质的探究实验,制得的乙烯中可能含有SO2、CO2等气体,将制得的乙烯通过溴水时,可观察到试管中溴水褪色.(1)甲同学认为:考虑到反应的复杂性,使溴水褪色的物质不一定是乙烯,理由是:______;
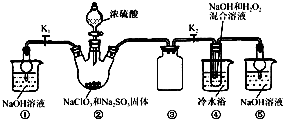
(2)乙同学设计了如图实验,证明乙烯可以使溴水褪色,则A中的试剂应为______,作用是______;B中的试剂应为______,作用是______;
(3)丙同学正确书写了溴水与乙烯反应的化学方程式为:______.

【答案】分析:(1)根据SO2具有还原性,也能与溴水反应使溴水褪色;
(2)根据A装置是为了除去SO2和CO2,B装置是为了检验SO2是否除尽;
(3)溴水中的溴与乙烯发生加成反应;
解答:解:(1)因SO2具有还原性,也能与溴水发生反应使溴水褪色,故答案为:SO2具有还原性,也能与溴水发生反应使溴水褪色;
(2)因A装置是为了除去SO2,可用NaOH溶液,B装置是为了检验SO2是否除尽,可用品红溶液,故答案为:NaOH溶液;除去混合气体中的SO2和CO2;品红溶液;检验SO2是否除尽;
(3)溴水中的溴与乙烯发生加成反应,即CH2=CH2+Br2→CH2BrCH2Br,故答案为:CH2=CH2+Br2→CH2BrCH2Br.
点评:本题结合实验考查了乙烯的化学性质,难度不大,培养了学生分析问题、解决问题的能力.
(2)根据A装置是为了除去SO2和CO2,B装置是为了检验SO2是否除尽;
(3)溴水中的溴与乙烯发生加成反应;
解答:解:(1)因SO2具有还原性,也能与溴水发生反应使溴水褪色,故答案为:SO2具有还原性,也能与溴水发生反应使溴水褪色;
(2)因A装置是为了除去SO2,可用NaOH溶液,B装置是为了检验SO2是否除尽,可用品红溶液,故答案为:NaOH溶液;除去混合气体中的SO2和CO2;品红溶液;检验SO2是否除尽;
(3)溴水中的溴与乙烯发生加成反应,即CH2=CH2+Br2→CH2BrCH2Br,故答案为:CH2=CH2+Br2→CH2BrCH2Br.
点评:本题结合实验考查了乙烯的化学性质,难度不大,培养了学生分析问题、解决问题的能力.

练习册系列答案
相关题目
 某化学兴趣小组制取并进行乙烯性质的探究实验,制得的乙烯中可能含有SO2、CO2等气体,将制得的乙烯通过溴水时,可观察到试管中溴水褪色.
某化学兴趣小组制取并进行乙烯性质的探究实验,制得的乙烯中可能含有SO2、CO2等气体,将制得的乙烯通过溴水时,可观察到试管中溴水褪色. 某化学兴趣小组制取并进行乙烯性质的探究实验,制得的乙烯中可能含有SO2、CO2等气体,将制得的乙烯通过溴水时,可观察到试管中溴水褪色.
某化学兴趣小组制取并进行乙烯性质的探究实验,制得的乙烯中可能含有SO2、CO2等气体,将制得的乙烯通过溴水时,可观察到试管中溴水褪色.