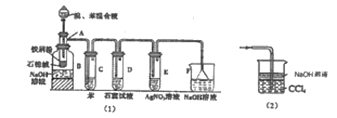
题目内容
【题目】高炉炼铁是冶炼铁的主要方法。
(1)从炼铁高炉口排出的尾气中含有一定量的有毒气体___(填化学式),会污染空气。100多年前,人们曾耗巨资改建高炉,结果尾气中的该物质含量并未减少。高炉炼铁的主要反应方程式为(设铁矿石用磁铁矿)____。
(2)已知:①4Fe(s) + 3O2=2Fe2O3(s) ΔH1
②4Fe3O4(s)+O2(g)=6Fe2O3(s) ΔH2
③3Fe(s)+2O2(g)=Fe3O4(s) ΔH3
则ΔH2=___(用含上述ΔH的代数式表示)。
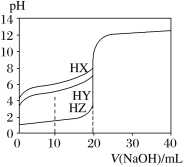
(3)高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用___(填H2SO4、HNO3、KOH、NaOH、Na2SO4)溶液,阳极反应式为___。
(4)某温度下,HX的电离平衡常数K=1×10-5。则该温度下0.100mol/L的HX溶液中c(H+)=___(平衡时HX的浓度以0.100mol/L计,水的电离忽略不计。)
【答案】CO Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g) 3ΔH1-4ΔH3 NaOH Fe-6e-+ 8OH-= FeO42-+ 4H2O 1×10-3mol·L-1
3Fe(s)+4CO2(g) 3ΔH1-4ΔH3 NaOH Fe-6e-+ 8OH-= FeO42-+ 4H2O 1×10-3mol·L-1
【解析】
(1)高炉炼铁,原料是铁矿和焦炭,先加焦炭,让焦炭转化成CO,然后加入铁矿石,CO还原铁的氧化物,得到铁单质,为了提高氧化铁的利用率,CO一定过量,即尾气中有毒的气体为CO,高炉炼铁的主要反应为4CO+Fe3O4 ![]() 4CO2+3Fe;
4CO2+3Fe;
答案为CO;4CO+Fe3O4 ![]() 4CO2+3Fe;
4CO2+3Fe;
(2)根据盖斯定律,②为目标反应方程式,因此有3×①-4×③,即△H2=3△H1-4△H2;
答案为3△H1-4△H2;
(3)因为制备高铁酸钠,根据电解原理,铁作阳极,即有Fe-6e-→FeO42-,电解质不能是酸,因为铁能与酸反应,因此只能选碱为电解质溶液,KOH不能选择,引入杂质K+,因此电解质溶液为NaOH,根据电荷守恒,有Fe-6e-+8OH-→FeO42-,根据原子守恒,阳极反应式为Fe-6e-+8OH-=FeO42-+4H2O;
答案为NaOH;Fe-6e-+8OH-=FeO42-+4H2O;
(4)根据电离平衡常数的表达式,即HX的电离平衡常数表达式为K=![]() ,HX的电离方程式为HX
,HX的电离方程式为HX ![]() H++X-,因为忽略水的电离,因此c(H+)=c(X-),c(HX)=0.1mol·L-1,电离平衡常数K=
H++X-,因为忽略水的电离,因此c(H+)=c(X-),c(HX)=0.1mol·L-1,电离平衡常数K=![]() =
=![]() =1×10-5,解得c(H+)=1×10-3mol·L-1;
=1×10-5,解得c(H+)=1×10-3mol·L-1;
答案为c(H+)=1×10-3mol·L-1。

【题目】甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N | C—H |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 | 414 |
则该反应的ΔH=____kJ·mol-1。
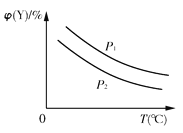
(2)上述反应中所需的甲醇工业上利用水煤气合成CO(g)+2H2(g)![]() CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
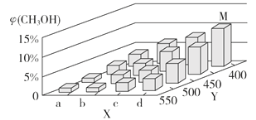
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②X轴上a点的数值比b点____ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_________________。
(3)工业上可采用CH3OH CO+2H2 来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
CO+2H2 来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为___(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
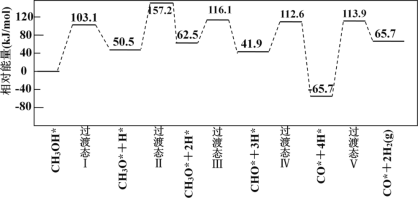
该历程中,放热最多的步骤的化学方程式为________。
(4)PbI2与金属锂以LiI-Al2O3固体为电解质组成锂碘电池,其结构示意图如下,电池总反应可表示为:2Li+PbI2=2LiI+Pb,则b极上的电极反应式为:_____。

(5)CH3NH2的电离方程式为CH3NH2+H2O![]() CH3NH3++OH-电离常数为kb,已知常温下pkb=-lgkb=3.4,则常温下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,溶液pH=______。
CH3NH3++OH-电离常数为kb,已知常温下pkb=-lgkb=3.4,则常温下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)时,溶液pH=______。
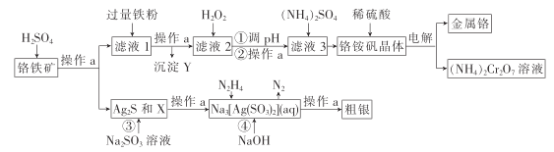
【题目】铬为高效催化剂的主要成分元素,从铬铁矿[主要含Ag2S、Cu2(OH)2CO3、FeO、Cr2O3、SiO2]中提取Cr、Ag的工艺流程如图:
已知:①部分阳离子以氢氧化物开始沉淀和完全沉淀的pH如下表(金属离子浓度为0.01mol·L-1)
沉淀物 | Fe(OH)2 | Fe(OH)3 | Cr(OH)3 |
开始沉淀的pH | 7.6 | 2.7 | 4.9 |
开始沉淀的pH | 9.6 | 3.7 | 6.8 |
②铬铵矾晶体:[NH4Cr(SO4)2·12H2O]
(1)操作a为___;X和Y分别为____、___。
(2)写出加入H2O2发生反应的离子方程式:___。
(3)调节pH值可用的物质的化学式为___,pH值应当控制的范围为__;由滤液3获得铬酸铵晶体的正确操作方法是___、过滤、洗涤、干燥。
(4)将铬铵矾晶体溶于硫酸而不是直接溶于水的主要原因是___。
(5)步骤④发生反应的离子方程式为___。