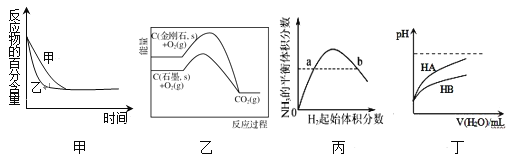
题目内容
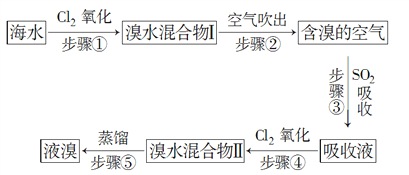
【题目】下图所示为海水综合利用部分流程,有关说法不正确的是
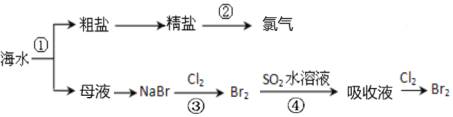
A.上述工艺流程中涉及到化合、分解、复分解和置换反应
B.①只发生物理变化
C.②是工业上电解饱和食盐水制备Cl2
D.③④涉及的反应均为氧化还原反应
【答案】A
【解析】
A.②是电解饱和食盐水或熔融的氯化钠,③是氯气和溴化钠反应生成溴单质,发生的是置换反应,④是二氧化硫和溴单质在水溶液中发生氧化还原反应生成硫酸和溴化氢,加入萃取剂萃取分液后蒸馏得到纯溴,过程中无化合反应、复分解反应,故A错误;
B.流程分析可知海水蒸发水分结晶得到粗盐和母液,无化学变化,故B正确;
C.工业可用电解饱和食盐水的方法制备氯气,故C正确;
D.③发生离子方程式为:2Br+Cl2=Br2+2Cl,④发生的离子方程式为:SO2+Br2+2H2O=4H++SO42+2Br,元素化合价都发生变化,属于氧化还原反应,故D正确;
故选:A。

 智慧小复习系列答案
智慧小复习系列答案【题目】(10分)某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。
(2)其操作步骤如下图所示,
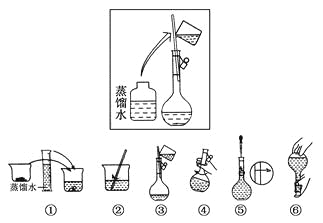
则如图操作应在下图中的________(填选项字母)之间。
A.②与③ B.①与② C.④与⑤
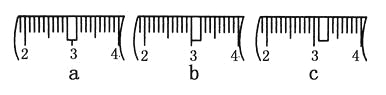
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表 砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会________。
【题目】在Na+浓度为0.5mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+ Ag+ Mg2+ Ba2+ |
阴离子 | NO3- CO32- Cl- SO42- |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀硝酸 | 放出标准状况下0.56L无色气体 |
Ⅱ | 向Ⅰ的反应混合液中加入过量的硝酸钡,产生白色沉淀,对沉淀洗涤、干燥,称量所得固体质量 | 固体质量为9.32克 |
Ⅲ | 向Ⅱ的滤液中滴加硝酸银溶液 | 无明显现象 |
请回答下列问题。
(1)实验Ⅰ能确定一定不存在的离子是___。
(2)实验Ⅰ中生成气体的离子方程式为___。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。___
阴离子 | NO3- | CO32- | Cl- | SO42- |
c/mol·L-1 |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:___。