题目内容
某课外兴趣小组测定某品牌牛奶中钙的含量,方法如下:
①取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;
②过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;
③将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;
④然后以0.10mol?L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液.
发生的反应为:
(1)配平上述方程式
(2)KMnO4溶液应盛在
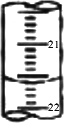
(3)若滴定管的规格为25mL,滴定前滴定管中液面的读数为5.20mL,则滴定管中液体的体积为
A.5.20mL B.19.80mL C.大于19.80mL D.小于19.80mL
(4)本实验是否需要外加指示剂?
(5)滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(6)该牛奶中钙的含量为
①取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;
②过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;
③将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;
④然后以0.10mol?L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液.
发生的反应为:
5
5
H2C2O4+2
2
KMnO4+3
3
H2SO4═10
10
CO2↑+2
2
MnSO4+1
1
K2SO4+3
3
H2O (1)配平上述方程式
(2)KMnO4溶液应盛在
酸式
酸式
(填“酸式”或“碱式”)滴定管中.(3)若滴定管的规格为25mL,滴定前滴定管中液面的读数为5.20mL,则滴定管中液体的体积为
C
C
(填代号).A.5.20mL B.19.80mL C.大于19.80mL D.小于19.80mL
(4)本实验是否需要外加指示剂?
否
否
(填“是”或者“否”).到达滴定终点时,溶液的颜色由紫红
紫红
色变为无
无
色.(5)滴定时边滴边摇动锥形瓶,眼睛应观察
B
B
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(6)该牛奶中钙的含量为
120
120
mg/100mL.分析:(1)根据化合价升降总数相等进行解题,再根据质量守恒定律得出正确结论;
(2)KMnO4溶液是强氧化剂,能腐蚀橡皮管;
(3)滴管尖嘴部的液体不计入刻度所示范围;
(4)高锰酸钾溶液为紫色,MnSO4溶液为无色;
(5)根据方程式进行计算,得出正确结论.
(2)KMnO4溶液是强氧化剂,能腐蚀橡皮管;
(3)滴管尖嘴部的液体不计入刻度所示范围;
(4)高锰酸钾溶液为紫色,MnSO4溶液为无色;
(5)根据方程式进行计算,得出正确结论.
解答:解:(1)C:+3→+4,↑1×2,×5
Mn:+7→+2,↓5,×2
H2C2O4前的化学计量数为5,CO2前的化学计量数为10,KMnO4和MnSO4前的化学计量数都为2,根据K守恒可知:K2SO4前的化学计量数都为1,根据硫酸根守恒可知:H2SO4前的化学计量数都为3,根据H守恒可知:H2O前的化学计量数都为3,
故答案为:5、2、3、10、2、1、3;
(2)KMnO4溶液是强氧化剂,能腐蚀橡皮管,故应选用酸式滴定管,
故答案为:酸式;
(3)25-5.20=19.80,由于滴管尖嘴部的液体不计入刻度所示范围,故滴定管中液体的体积大于19.80mL,
故答案为:C;
(4)高锰酸钾溶液为紫色,MnSO4溶液为无色,滴定终点时由紫色变为无色,无需另加指示剂,
故答案为:否;紫色;无色;
(5)KMnO4溶液的物质的量为0.1×0.012=0.0012mol,根据方程式可知:H2C2O4溶液的物质的量为0.0012÷2×5=0.0003mol,则钙的物质的量为0.0003mol,故钙的质量为0.0003×40=0.012g=120mg,
故答案为:120.
Mn:+7→+2,↓5,×2
H2C2O4前的化学计量数为5,CO2前的化学计量数为10,KMnO4和MnSO4前的化学计量数都为2,根据K守恒可知:K2SO4前的化学计量数都为1,根据硫酸根守恒可知:H2SO4前的化学计量数都为3,根据H守恒可知:H2O前的化学计量数都为3,
故答案为:5、2、3、10、2、1、3;
(2)KMnO4溶液是强氧化剂,能腐蚀橡皮管,故应选用酸式滴定管,
故答案为:酸式;
(3)25-5.20=19.80,由于滴管尖嘴部的液体不计入刻度所示范围,故滴定管中液体的体积大于19.80mL,
故答案为:C;
(4)高锰酸钾溶液为紫色,MnSO4溶液为无色,滴定终点时由紫色变为无色,无需另加指示剂,
故答案为:否;紫色;无色;
(5)KMnO4溶液的物质的量为0.1×0.012=0.0012mol,根据方程式可知:H2C2O4溶液的物质的量为0.0012÷2×5=0.0003mol,则钙的物质的量为0.0003mol,故钙的质量为0.0003×40=0.012g=120mg,
故答案为:120.
点评:本题是一道有关氧化还原反应的综合题,考查角度很广,涉及了中和滴定和物质的量的计算,对学生的分析和解决问题的能力要求较高,难度较大.

练习册系列答案
相关题目
| |||||||||||||||||||||||||||||||||
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: