题目内容
| 高温 |
| A、一定条件下,任何可逆反应的进程都有一定的限度,所以CO不可能完全转化 |
| B、尾气中CO的比例不变,说明反应达到了这一条件下的化学平衡状态 |
| C、尾气中CO的比例不变,是因为CO 的消耗速率与CO 生成速率相等 |
| D、CO是气体,铁矿石(主要成分Fe2O3)是固体,CO 与铁矿石接触不充分 |
B.平衡时各组分的含量不变;
C.尾气中CO的比例不变,反应到达平衡状态;
D.增加高炉的高度,使CO与铁矿石充分接触,但尾气中CO的比例不变,说明不是CO与铁矿石接触不充分导致.
B.平衡时各组分的含量不变,尾气中CO的比例不变,反应到达平衡状态,故B正确;
C.尾气中CO的比例不变,反应到达平衡状态,正、逆速率相等,故C正确;
D.增加高炉的高度,使CO与铁矿石充分接触,但尾气中CO的比例不变,说明不是CO与铁矿石接触不充分导致,可逆反应存在限度,反应物不能完全转化,故D错误;
故选D.

 字词句段篇系列答案
字词句段篇系列答案(4分)欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用酚酞作指示剂)。
请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为 ;
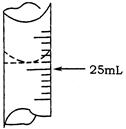
(2)乙学生做了三组平行实验,数据记录如下:
|
实验序号 |
待测NaOH溶液的体积/mL |
0.1000mol·L-1HCl溶液的体积/mL |
|
|
滴定前刻度 |
滴定后刻度 |
||
|
1 |
25.00 |
0.00 |
26.11 |
|
2 |
25.00 |
1.56 |
31.30 |
|
3 |
25.00 |
0.22 |
26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (小数点后保留四位);
(3)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
① Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H= ―24.8 kJ?mol-1
② 3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2 kJ?mol-1
③ Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5 kJ?mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
__________________________________________________。
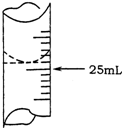 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).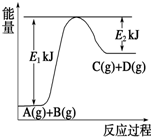 Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.