��Ŀ����
7��ʳƷ�㾫������M��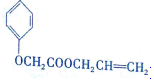 ��������·�ߣ���Ӧ������ȥ����ͼ��
��������·�ߣ���Ӧ������ȥ����ͼ��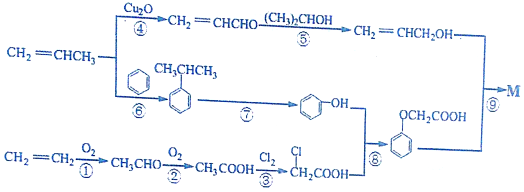
�ش��������⣺
��1��������Ӧ�Т۵ķ�Ӧ������ȡ����Ӧ���ķ�Ӧ�����Ǽӳɷ�Ӧ��
��2��
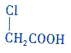 �еĹ�������������ԭ�ӡ��Ȼ���
�еĹ�������������ԭ�ӡ��Ȼ�����3����Ӧ��Ļ�ѧ����ʽΪ
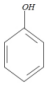 +
+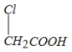 ��
��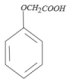 +HCl��
+HCl����4����Ӧ�ݺ߳͢�����Ŀ������⣬��������ͬһ�ָ����N����N���ܷ���������Ӧ����N�Ľṹ��ʽΪCH3COCH3��
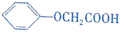 �ж���ͬ���칹�壬���м����ڷ��ࡢ�����������ұ�����������ȡ������ͬ���칹����9�֣�
�ж���ͬ���칹�壬���м����ڷ��ࡢ�����������ұ�����������ȡ������ͬ���칹����9�֣���5���Ա�ϩΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�
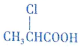 ��д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ�����
��д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ�����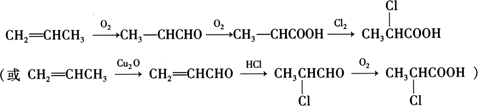 ��
��
���� ��1����Ӧ��ΪCl2�е�Clԭ��ȡ�������м������һ��Hԭ�ӣ���Ӧ��Ϊ��ϩ�ͱ���Ӧ���� ��
��
��2�������Ĺ������л�������Ȼ���±ԭ�ӣ�̼̼˫����̼̼������ȩ�����������Ѽ����ǻ��ȣ���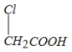 �У����еĹ�����Ϊ��ԭ�ӣ��Ȼ���
�У����еĹ�����Ϊ��ԭ�ӣ��Ȼ���
��3����Ӧ��Ϊ���Ӻ�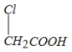 ��Ӧ����HCl��
��Ӧ����HCl�� ��
��
��4����Ӧ�ݺ߳͢�����Ŀ������⣬������һ�ָ�����N��ΪC3H6O���䲻���Ͷ�Ϊ1������һ��˫�������ڲ�����������Ӧ�����NΪ��ͪ�� �ж���ͬ���칹�壬�����м����ڷ��ࡢ�����������ұ�����������ȡ������������Ӧ�з��ǻ������������ڱ�����ֻ������ȡ���������������Ӧ������������������ͬ���͵Ľṹ��
�ж���ͬ���칹�壬�����м����ڷ��ࡢ�����������ұ�����������ȡ������������Ӧ�з��ǻ������������ڱ�����ֻ������ȡ���������������Ӧ������������������ͬ���͵Ľṹ��
��5���Ա�ϩΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ� ���������ͼ�������Ϣ���
���������ͼ�������Ϣ���
��� �⣺��1����Ӧ��ΪCl2�е�Clԭ��ȡ�������м������һ��Hԭ�ӣ���Ӧ����Ϊȡ����Ӧ����Ӧ��Ϊ��ϩ�ͱ���Ӧ���� ����Ӧ����Ϊ�ӳɷ�Ӧ���ʴ�Ϊ��ȡ����Ӧ���ӳɷ�Ӧ��
����Ӧ����Ϊ�ӳɷ�Ӧ���ʴ�Ϊ��ȡ����Ӧ���ӳɷ�Ӧ��
��2��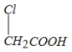 �����к��еĹ���������ԭ�ӣ��Ȼ����ʴ�Ϊ����ԭ�ӣ��Ȼ���
�����к��еĹ���������ԭ�ӣ��Ȼ����ʴ�Ϊ����ԭ�ӣ��Ȼ���
��3����Ӧ��Ϊ���Ӻ�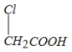 ��Ӧ����HCl��
��Ӧ����HCl�� ����Ӧ����ʽΪ��
����Ӧ����ʽΪ�� +
+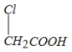 ��
�� +HCl���ʴ�Ϊ��
+HCl���ʴ�Ϊ�� +
+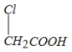 ��
�� +HCl��
+HCl��
��4����Ӧ�ݺ߳͢�����Ŀ������⣬������һ�ָ�����N��ΪC3H6O���䲻���Ͷ�Ϊ1������һ��˫�������ڲ�����������Ӧ�����NΪCH3COCH3�� �����к��з��ǻ����������ұ�����ֻ������ȡ������ͬ���칹�壬��
�����к��з��ǻ����������ұ�����ֻ������ȡ������ͬ���칹�壬�� �����ڣ��䣬�ԣ���3�֣�
�����ڣ��䣬�ԣ���3�֣� ���ڣ��䣬�ԣ���3�֣�
���ڣ��䣬�ԣ���3�֣� ���ڣ��䣬�ԣ���3�֣���˹���3+3+3=9�֣��ʴ�Ϊ��CH3OCH3��9��
���ڣ��䣬�ԣ���3�֣���˹���3+3+3=9�֣��ʴ�Ϊ��CH3OCH3��9��
��5���Ա�ϩΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ� ����������ͼ��غϳ���Ϣ���ϳ�·��Ϊ��
����������ͼ��غϳ���Ϣ���ϳ�·��Ϊ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
���� ���⿼���л��ϳɣ�ͬ���칹�����д���л���Ӧ���ͣ��л���Ӧ����ʽ����д��ע��ʹ�õ��Ǽ�ͷ������������Ӧ����ʽ����Ŀ�ѶȲ����ǻ����⣮

 �������ϵ�д�
�������ϵ�д�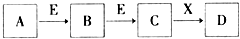 ��ѧ��������A��B��C��D��E��X��������ͼת����ϵ������������ͷ�Ӧ������ȥ���������ƶϲ���ȷ���ǣ�������
��ѧ��������A��B��C��D��E��X��������ͼת����ϵ������������ͷ�Ӧ������ȥ���������ƶϲ���ȷ���ǣ�������| A�� | ��D��һ�ְ�ɫ�������ڿ��������ձ�Ϊ���ɫ����A�������� | |
| B�� | ��DΪNaOH����A��B��C������X��Ӧ����D | |
| C�� | ��DΪNaCl����A����C��Ӧ����B����E������CO2 | |
| D�� | ��DΪH2SO4����A�ȿ����ǵ��ʣ�Ҳ�����ǻ������D����ͭ��Ӧ����B��C |
| A�� | ��Ӧ���������������������������ķ�Ӧһ�������ȷ�Ӧ | |
| B�� | ��ϡ�����м���ͭ�ۣ�ͭ�۲��ܽ⣬�ټ���Cu��NO3��2���壬ͭ���Բ��ܽ� | |
| C�� | ͭ��ϡ���ᷴӦ�����ӷ���ʽΪ3Cu+8H++2NO3-�T3Cu2++2NO��+4H2O | |
| D�� | �����Ļ�ԭ�Կ��Խ��Ͱ������Ȼ���ķ�Ӧʵ�� |
| A�� | ǿ������Һ�У�K+��Mg2+��SO42- | |
| B�� | pH=1��������Һ�У�Fe3+��Na+��Cl- | |
| C�� | pH=1��������Һ�У�AlO2-��Na+��SO42- | |
| D�� | ij��ɫ��Һ�У�Al3+��K+��OH- |
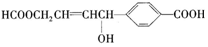 ����������ȷ���ǣ�������
����������ȷ���ǣ�������| A�� | 1 mol���л��������3 mol Na������Ӧ | |
| B�� | 1 mol���л��������3 mol NaOH������Ӧ | |
| C�� | 1 mol���л��������6 mol H2�����ӳɷ�Ӧ | |
| D�� | 1 mol���л���ֱ�������Na��NaHCO3��Ӧ����������������ͬ������������ |
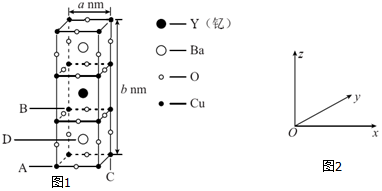
 �裨Si�����أ�Ga��������Se���Ļ�����������̫���ܵ�ص���Ҫ���ϣ�
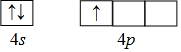
�裨Si�����أ�Ga��������Se���Ļ�����������̫���ܵ�ص���Ҫ���ϣ���1����̬��ԭ�ӵ���Χ�����Ų�ʽΪ4s24p1����̬��ԭ�Ӻ�����ӵ��˶�״̬��14�֣�
��2����֪H2SeO4 �����Խӽ����ᣬ���ڹ衢�غ�������Ԫ���У��縺������������H2SeO4����ԭ�ӵ��ӻ���ʽΪsp3��SeO3�Ŀռ乹����ƽ�������Σ�
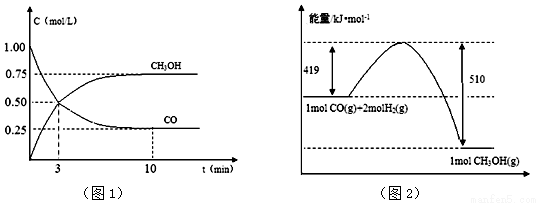
��3���±��г���SiX4 �ķе㼰Si-X ���ļ������������SiX4 �ķе�仯������Si-X ���ļ����仯���µģ�����Ϊ����۵㲻������������������������������ǣ�SiX4����ʱ�ƻ����Ӽ������������ƻ����ۼ������Թ��ۼ��ļ�����SiX4�е�������Ӱ�죻
| SiF4 | SiCl4 | SiBr4 | SiI4 | |
| �е㣨K�� | 177.4 | 330.1 | 408 | 460.6 |
| Si-X��������pm�� | 154 | 201 | 215 | 234 |
| A�� | �������κ�����¾�����ǿ�ᡢǿ���������Ӧ | |
| B�� | ��ϩʹ���Ը��������Һ��������Ȼ�̼��Һ��ɫ�ķ�Ӧ������ͬ | |
| C�� | ����������ϩ�Ͷ�ϩ��ȫȼ�գ���ϩ������ | |
| D�� | ��Է�����������Ĵ��������е������Ϊ�����Ӽ������� |