题目内容
常温下,0.1 mol·L-1某一元酸(HA)溶液中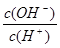 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中离子浓度大小关系为:c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
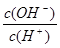 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中离子浓度大小关系为:c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D
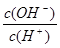 =1×10-8,则根据水的离子积常数可知,溶液中氢离子浓度是10-3mol/L,这说明酸是弱酸。溶液中OH-的浓度是10-11mol/L,溶液中水电离出的c(H+)=10-11mol/L,A不正确。B不正确,根据物料守恒应该是c(HA)+c(A-)=0.1 mol·L-1。根据电荷守恒可知c(A-)+c(OH-)=c(Na+)+c(H+),所以选项C是不正确的,因此正确的答案选D。
=1×10-8,则根据水的离子积常数可知,溶液中氢离子浓度是10-3mol/L,这说明酸是弱酸。溶液中OH-的浓度是10-11mol/L,溶液中水电离出的c(H+)=10-11mol/L,A不正确。B不正确,根据物料守恒应该是c(HA)+c(A-)=0.1 mol·L-1。根据电荷守恒可知c(A-)+c(OH-)=c(Na+)+c(H+),所以选项C是不正确的,因此正确的答案选D。
练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
 CH3COO-+H+ 对于该平衡,下列叙述正确的是
CH3COO-+H+ 对于该平衡,下列叙述正确的是 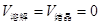
 、5.0×10
、5.0×10 、8.3×10
、8.3×10 。下列有关说法错误的是 ( )
。下列有关说法错误的是 ( )