题目内容
【题目】25℃时,将浓度均为0.1mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,且保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示.下列说法正确的是
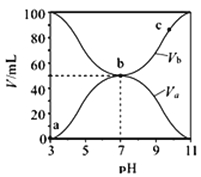
A. Ka(HA)≈1×10-6
B. c点时, 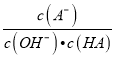 随温度升高而增大
随温度升高而增大
C. a→c过程中水的电离程度始终增大
D. b点时,c(B+)=c(A-)
【答案】D
【解析】从图中得到初始条件下,浓度为0.1mol·L-1的HA溶液的pH为3,根据弱酸氢离子浓度的近似计算公式c(H+)=![]() ,所以Ka=1×10-5,选项A错误。
,所以Ka=1×10-5,选项A错误。 可以认为是A-水解平衡常数的倒数,水解反应是吸热的,温度升高水解平衡常数增大,所以其倒数
可以认为是A-水解平衡常数的倒数,水解反应是吸热的,温度升高水解平衡常数增大,所以其倒数 的值减小,选项B错误。B点代表加入的HA和BOH恰好中和得到BA的盐溶液,该溶液阴阳离子都水解,对于水的电离都起到促进作用,所以b点睡的电离程度最大。a点是酸过量,溶液显酸性,对于水的电离起到抑制作用;c点是碱过量,溶液显碱性,对于水的电离也起到抑制作用;所以a→c过程中水的电离程度先增大后减小,选项C错误。b点pH等于7,溶液显中性,c(H+)= c(OH-),再根据电荷守恒得到c(B+)=c(A-)。选项D正确。
的值减小,选项B错误。B点代表加入的HA和BOH恰好中和得到BA的盐溶液,该溶液阴阳离子都水解,对于水的电离都起到促进作用,所以b点睡的电离程度最大。a点是酸过量,溶液显酸性,对于水的电离起到抑制作用;c点是碱过量,溶液显碱性,对于水的电离也起到抑制作用;所以a→c过程中水的电离程度先增大后减小,选项C错误。b点pH等于7,溶液显中性,c(H+)= c(OH-),再根据电荷守恒得到c(B+)=c(A-)。选项D正确。

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目