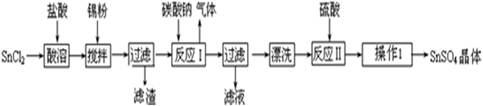
��Ŀ����
(1)ij����ÿ��Ҫ�յ�����1.6%����ú200 t,�ŷų���SO2��������Ⱦ����,������Ϊ��,����ЩSO2��������,��ô������ÿ��(��365 d��)������98%��Ũ������������;
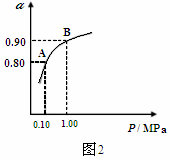
(2)��Ҫ�����Ƽ��������,����Ӧ���Դ����������������,���Һ��������������Һ,��ƹ�������������Һ��Ũ�Ȼ���������(�������С�����䡱);
(3)��ҵ������ˮ�ࡢ����ʱ��Ҫ�õ���ԭ������������(����),����ѡԭ���Ʋ����Ļ�ѧ����ʽ���� ��;
| A������ | B����ʯ�� | C��ʯ��ʯ | D����� |
(5)��������ˮ��ԭ����
(�����ӷ���ʽ��ʾ);������ʱӲ�ȵ�ˮ�г�ȥMg2+�ķ������� ��
�� (�û�ѧ����ʽ��ʾ)��
(1)3 650
(2)��������
(3)C��CaCO3+SiO2 CaSiO3+CO2��
CaSiO3+CO2��
(4)���������û�ԭ���������������л�ԭ����,�����������������������й����̼���������ʳ�ȥ
(5)Al3++3H2O Al(OH)3+3H+��Mg(HCO3)2
Al(OH)3+3H+��Mg(HCO3)2 MgCO3��+CO2��+H2O��MgCO3+H2O
MgCO3��+CO2��+H2O��MgCO3+H2O Mg(OH)2+CO2��
Mg(OH)2+CO2��
����

 һ����������ϵ�д�
һ����������ϵ�д������������ڸ��ϲ��ϵ���
| A����ͨ���� | B����ͨ�� | C�������� | D��þ���Ͻ� |
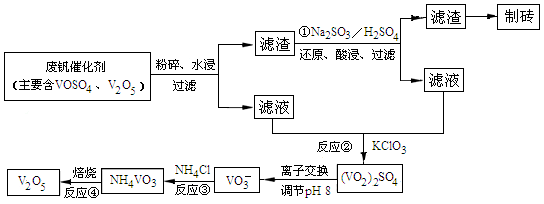
�����ѣ�Ti������Ӳ�ȴ��۵�ߡ�����ʱ����ʴ�����㷺�������¿Ƽ����ϣ�����Ϊ��δ��������������������Ҫ�ɷ�FeTiO3������������Ϊ��Ҫԭ��ұ��������ͬʱ��ø���Ʒ�Ĺ�ҵ�����������£��ش��������⣺
��1���������Ũ���ᷴӦ�IJ���֮һ��TiOSO4����Ӧ�����������ɡ�����Ʒ���׳ơ��̷����仯ѧʽ��________________��
��2���������������м���Feм��Ŀ���� �������ӷ���ʽ��ʾ�������鸱��Ʒ���Ƿ���ʵ�ʵ�鷽���� ��
��3�������������������õ��Ľ������л����������ʣ��ɼ��� �ܽ���ȥ��
��4����Һ���к���Fe2+��TiO2+������Mg2+�������ӡ������£����Ӧ���������Ksp���±���ʾ��
| �������� | Fe��OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0��10-16 | 1.0��10-29 | 1.8��10-11 |
����������Fe2+��TiO2+��Mg2+����Һ��ˮϡ�ͣ���������������ɫ������д���÷�Ӧ�����ӷ���ʽ��__________________________________________________________________
��5��Mg��ԭTiCl4�����б�����1070K���¶��½��У�����Ϊ��Ӧ���Ƶķ�Ӧ������__________________________
��6����800--1000��ʱ���TiO2Ҳ���Ƶú����ѣ�װ����ͼ��ʾ��ͼ��b�ǵ�Դ��______���������ĵ缫��Ӧʽ________________��

ij��ѧС����ʵ����ģ�������̿���Ҫ�ɷ�MnO2������Ϊ����ͭ�Ļ�����ȣ��Ʊ��ߴ�̼���̣��������£����ֲ����������ԣ���
�� ��������ƿ�У���ͼ��ͨ�������������С����̡���������Ҫ��Ӧԭ��Ϊ��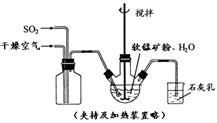
SO2+ H2O = H2SO3
MnO2+ H2SO3 = MnSO4+ H2O
��������������SO2 �ὫFe3+��ԭΪFe2+��
�� ���̡����������ƿ�м���һ������MnO2��ĩ��
�� ����Na2CO3��Һ����pHΪ3.5���ң����ˡ�
�� ������ҺpHΪ6.5��7.2 ������NH4HCO3 ����dz��ɫ�ij������ɣ����ˡ�ϴ�ӡ�����õ��ߴ�̼���̡�
�ش�
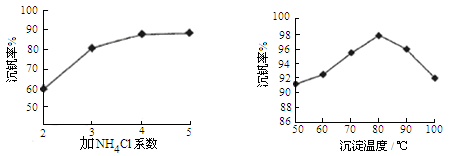
��1�������̡���Ӧ�������и�����MnS2O6 �����ɣ��¶ȶԡ����̡���Ӧ��Ӱ������ͼ��Ϊ����MnS2O6�����ɣ������̡��������¶��� ��
��2�����ı�1�����е�pHΪ3.5ʱ��������Ҫ�ɷ��� �����м���һ������MnO2��ĩ����Ҫ������ ����Ӧ��Ӧ�����ӷ���ʽΪ ��
��1��������Ӧ���������pH
| ���� | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| ��ʼ����pH | 2.7 | 7.6 | 8.3 | 4.7 |
| ��ȫ����pH | 3.7 | 9.6 | 9.8 | 6.7 |
��3���������õ���Һ�к���Cu2+�������ӹ��������ܵ����MnS��ȥCu2+�������ˣ��õ�������MnSO4����ƽ���ƶ�ԭ�����ͼ���MnS������_________________��
��4�����м���NH4HCO3 ������Ӧ�����ӷ���ʽ��____________________��
��5��������г����Ƿ�ϴ�Ӹɾ��ķ����� ��

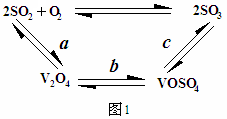

 Fe3++3H2O��ƽ�ⳣ��K= ��
Fe3++3H2O��ƽ�ⳣ��K= ��