题目内容
以下是对重要非金属及其化合物的讨论,根据要求回答问题:
(1)实验室盛装NaOH溶液是试剂瓶不能用玻璃塞,应该用橡胶塞,以防止发生反应:
(离子方程式)。
(2)氨是一种重要的化工产品,密度比空气 (填“大”或“小”)。工业上制备氨气的化学方程式为 。
(3)工业上制取漂白粉的反应化学方程式为 。
(4)浓H2SO4常用作气体干燥剂,是因为它具有____________;将适量的蔗糖放入烧杯中,滴入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
产生刺激性气味气体的化学方程式为 。
(5)铜和稀硝酸反应的离子方程式是 。若参加反应的Cu质量为6.4g,生成NO气体____________L(标准状况下),则转移电子物质的量为 mol,被还原的与未被还原的HNO3物质的量之比为 。
(1) SiO2+2OH-===SiO32-+H2O 。
(2) 小 , N2+3H2=高温高压催化剂= 2NH3 。
(3) 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O 。
(4) 吸水性, C+2H2SO4====CO2↑+2SO2↑+2H2O 。
(5) 3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O , 1.49L(或1.5L) ,
0.2 mol , 1:3 。

(1)将水蒸气通过红热的碳即可产生水煤气,其反应为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1,
①该反应在
②煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
(2)利用水煤气作为合成气,在同一个容器中,选择双催化剂,经过如下三步反应,最终合成二甲醚,此工艺称之为“一步法”合成二甲醚.
| 反应过程 | 化学方程式 | △H(kJ?mol-1) |
| 甲醇合成反应 | 2H2(g)+CO(g)=CH3OH(g) | -90.8 |
| 水煤气变换反应 | CO(g)+H2O(g)═CO2(g)+H2(g) | -41.3 |
| 甲醇脱水反应 | 2CH3OH(g)=CH3OCH3(g)+H2O(g) | -23.5 |
②该反应在一定条件下的密闭容器中达到平衡后,为同时提高化学反应速率和二甲醚的产率,可以采取的措施是
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
(3)控制反应条件,水煤气作为合成气也可以用来合成甲醇.在相同条件下合成二甲醚和合成甲醇的原料转化率随氢碳比的变化如图所示:
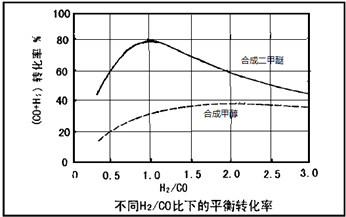
①合成二甲醚的最佳H2/CO比为
②以水煤气作为原料气,在相同条件下一步法合成二甲醚的转化率为什么明显高于合成甲醇的转化率