题目内容
氨气具有广泛的用途。
(1)工业上合成氨反应的化学方程式是 。
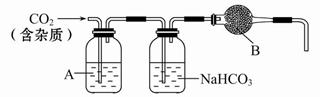
(2)实验室常用如下图所示装置制取并收集氨气。
①实验室制取氨气反应的化学方程式是 。
②图中方框内收集氨气的装置可选用 (填字母序号)。
③尾气处理装置中使用倒扣漏斗的作用是 。
(3)工业上用NH3制取NO反应的化学方程式是 。
(1)N2+3H2 2NH3
2NH3
(2)①2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O ②C ③防止烧杯中的水倒吸
CaCl2+2NH3↑+2H2O ②C ③防止烧杯中的水倒吸
(3)4 NH3+ 5O2 4NO+6H2O
4NO+6H2O
解析试题分析:(1)在工业上合成氨气的化学反应方程式为N2+3H2 2NH3(2)①实验室制取氨气反应的化学方程式是2NH4Cl+Ca(OH)2
2NH3(2)①实验室制取氨气反应的化学方程式是2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O,②由于氨气极易溶解于水,所以不能用排水法收集,氨气的密度比空气小,所以可用向下排空气法来收集,选项装置为C。③氨气极易溶解于水,导致导气管内的压强减小,烧杯中的水在大气压强的作用下,被压入导气管,最后进入到收集装置。所以尾气处理装置中使用倒扣漏斗的作用是防止烧杯中的水倒吸。(3)工业上用NH3制取NO反应的化学方程式是4 NH3+ 5O2
CaCl2+2NH3↑+2H2O,②由于氨气极易溶解于水,所以不能用排水法收集,氨气的密度比空气小,所以可用向下排空气法来收集,选项装置为C。③氨气极易溶解于水,导致导气管内的压强减小,烧杯中的水在大气压强的作用下,被压入导气管,最后进入到收集装置。所以尾气处理装置中使用倒扣漏斗的作用是防止烧杯中的水倒吸。(3)工业上用NH3制取NO反应的化学方程式是4 NH3+ 5O2 4NO+6H2O。这种方法叫氨气的催化氧化法。
4NO+6H2O。这种方法叫氨气的催化氧化法。
考点:考查NH3的工业制法、实验室制法、收集、尾气处理及用途。

二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 | ||
| S | 112.8 | 444.6 | 略 | ||
| S2Cl2 | -77 | 137 |
|
设计实验装置图如下:

(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见 。利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式: 。E中反应的化学方程式: 。
(3)C中的试剂是 。
(4)仪器B的名称是 。F的作用是 。
(5)如果在加热E时温度过高,对实验结果的影响是 。
(6)S2Cl2粗品中可能混有的杂质是(填写两种) ,为了提高S2Cl2的纯度,关键的操作是控制好温度和 。
选用适当装置、试剂和方法可制备中学化学中的几种常见气体。请填写表中的空格(从①~⑩中选择,填序号):
| 实验 | 气体 | 所用装置 | 气体性质 | 干燥该气体选用的试剂 |
| (1) | | ③ | 其水溶液显碱性 | |
| (2) | | | 1mol最多能与2molH2反应 | ⑩ |

⑤Cl2 ⑥C2H2
⑦C2H4 ⑧NH3
⑨碱石灰 ⑩浓H2SO4
下列对实验现象的解释与结论,正确的是( )
| 选项 | 实验操作 | 实验现象 | 解释与结论 |
| A | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液 | 有白色沉淀产生 | 蛋白质发生了变性 |
| B | 向某溶液中加入盐酸酸化的BaCl2溶液 | 有白色沉淀产生 | 该溶液中一定含有SO42- |
| C | 向甲苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 甲苯和溴水发生取代反应,使溴水褪色 |
| D | 向蔗糖中加入浓硫酸 | 变黑,放热,体积膨胀,放出刺激性气体 | 浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等 |


 FeSO4+H2↑
FeSO4+H2↑ +5C2
+5C2 +16H+
+16H+



 )__________________________________。
)__________________________________。