题目内容
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A.2SO2(g)+O2(g)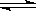 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
B.2SO2(g)+O2(g)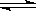 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+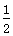 O2(g)
O2(g)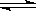 SO3(g) ΔH=+98.3 kJ·mol-1
SO3(g) ΔH=+98.3 kJ·mol-1
D.SO2(g)+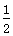 O2(g)
O2(g)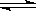 SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
A
【解析】
试题分析:将2mol SO2、1mol O2充入一密闭容器中充分反应后,放出热量98.3kJ,此时测得SO2的物质的量为1mol,说明反应是可逆反应,不能进行彻底,实际发生反应的二氧化硫为1mol,1mol二氧化硫全部反应放热98.3KJ,热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-196.6 kJ?mol-1或SO2(g)+ O2(g)?SO3(g)△H=-98.3 kJ?mol-1;A、选项中的热化学方程式符合题意,故A正确;B、选项中的热化学方程式中反应热和对应二氧化硫的量不符合,故B错误;C、反应是放热反应,故C错误;D、反应是放热反应,故D错误;
O2(g)?SO3(g)△H=-98.3 kJ?mol-1;A、选项中的热化学方程式符合题意,故A正确;B、选项中的热化学方程式中反应热和对应二氧化硫的量不符合,故B错误;C、反应是放热反应,故C错误;D、反应是放热反应,故D错误;
考点:热化学方程式的书写

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案
相关题目


 、Na+ B.H+、Br-、
、Na+ B.H+、Br-、 、K+
、K+ 、Br-、OH-、Fe2+ D.H+、Br-、
、Br-、OH-、Fe2+ D.H+、Br-、