题目内容
12.实验室以电石(主要成分是CaC2)为原理制备乙炔:(1)实验室制取乙炔的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑.
(2)为避免电石和水反应过于激烈,除用饱和食盐水代替水外,还需采取的措施是控制分液漏斗的活塞,使液体缓慢滴下.
(3)为除去乙炔中混有的少量硫化氢杂质,可将气体通过c(选填编号).
a.酸性KMnO4溶液 b.CCl4 c.NaOH溶液
(4)乙炔在一定条件下三聚得到CH2=CH-C≡C-CH=CH2,写出与该三聚物具有相同化学式且不易发生加成反应的物质的结构简式.
(5)乙炔聚合得到聚乙炔,聚乙炔能导电(选填“能”或“不能”).
(6)乙炔在不同的催化条件下加氢可得到不同的产物.下列物质与乙炔加氢得到的某种产物互为同系物的是d(选填编号).
a.C2H4 b.C2H6 c.
 d.CH2=CHCH3.
d.CH2=CHCH3.
分析 (1)实验室制备乙炔利用碳化钙和水反应生成乙炔和氢氧化钙;
(2)电石与水反应速率太快,通常利用饱和食盐水代替水同时控制分液漏斗的活塞,使液体缓慢滴下以减慢化学反应速率;
(3)酸性KMnO4溶液能氧化乙炔,四氯化碳不吸收硫化氢,氢氧化钠与乙炔不反应,能吸收硫化氢;
(4)根据分子式确定不饱和度,利用不饱和度、性质确定结构;
(5)根据碳碳单键、碳碳双键交替出现的有机物能导电;
(6)根据乙炔在不同的催化条件下加氢可得到乙烯、乙烷,然后根据结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物来判断.
解答 解:(1)实验室制备乙炔利用碳化钙和水反应生成乙炔和氢氧化钙,反应为CaC2+2H2O→Ca(OH)2+C2H2↑,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)碳化钙和水之间的反应十分剧烈,为减慢反应速率,可以将水换成饱和食盐水,可以利用分液漏斗的活塞调节滴加饱和食盐水的速率,以减慢化学反应速率,
故答案为:控制分液漏斗的活塞,使液体缓慢滴下;
(3)a.酸性KMnO4溶液能氧化硫化氢,也能氧化乙炔为二氧化碳,故a错误;
b.四氯化碳不吸收硫化氢,氢氧化钠与乙炔不反应,故b错误;
c.氢氧化钠和硫化氢反应生成硫化钠和水,氢氧化钠和乙炔不反应,故c正确;
故答案为:c;
(4)CH2=CH-C≡C-CH=CH2的分子式为C6H6,不饱和度为4,不易发生加成反应,说明不含有典型的双键、三键,所以结构简式为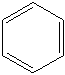 ;
;
故答案为: ;
;
(5)乙炔生成聚乙炔:nC2H2$\stackrel{催化剂}{→}$-[-CH=CH-]n-,聚乙炔中碳碳单键、碳碳双键交替出现,所以能导电;
故答案为:能;
(6)乙炔在不同的催化条件下加氢可得到乙烯、乙烷,而C2H4为乙烯,C2H6为乙烷,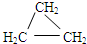 与乙烯、乙烷的结构都不相似,不属于同系物,CH2=CHCH3与乙烯结构相似,在分子组成上相差1个CH2,属于同系物,
与乙烯、乙烷的结构都不相似,不属于同系物,CH2=CHCH3与乙烯结构相似,在分子组成上相差1个CH2,属于同系物,
故选d.
点评 本题考查了乙炔的制备和性质实验,题目难度中等,注意乙炔的除杂和性质实验,注意与高锰酸钾溶液反应的物质性质,充分考查了学生对所学知识的综合运用.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案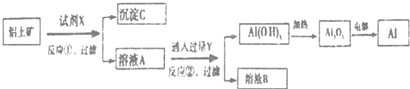
下列叙述正确的是( )
| A. | 反应①中试剂X是氢氧化钠溶液 | |
| B. | 试剂Y是HCI,它与AlO2-反应生成氢氧化铝 | |
| C. | 图中所示转化反应中包含2个氧化还原反应 | |
| D. | 将X与Y试剂进行对换,最终可以达到相同结果 |
| A. | CO2(HCl):饱和碳酸钠溶液,洗气 | B. | 溴苯(溴):稀NaOH溶液,分液 | ||
| C. | 乙烷(乙烯):酸性KMnO4溶液,洗气 | D. | 乙醇(乙酸):KOH溶液,分液 |
①CH2=CHCOOH
②CH2=CHOOCH3
③CH2=CHCH2OH
④CH3CH2CH2OH
⑤

| A. | ①③④ | B. | ②④⑤ | C. | ①③⑤ | D. | ①②⑤ |
(1)按物质的分类方法填写表格的空白处(填写序号):1⑦⑧⑨;2③④;3③⑤⑥⑩;
| 分类标准 | 混合物 | 氧化物 | 电解质 |
| 属于该类的物质 | 1 | 2 | 3 |
(3)写出下列物质之间反应的离子方程式:少量的④通入⑥的水溶液CO2+Ba2++2OH-═BaSO4↓+H2O;⑤的水溶液与⑥的水溶液混合2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(4)质量都是10g的HCl、NH3、CO2、H2四种气体在标准状况下,体积最小的是CO2,密度最小的是H2;(填分子式)
(5)②与⑨发生反应的化学方程式为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,HNO3是氧化剂,Cu元素被氧化,参加反应的HNO3中,n(HNO3)被还原:n(HNO3)未被还原=1:3,当有6.4gCu发生反应时,转移电子的物质的量为0.2mol.
①2Fe3++2I-=2Fe2++I2 ②2Fe2++Cl2=2Fe3++2Cl-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O.
| A. | Fe3+>C12>MnO4- | B. | MnO4->Cl2>Fe3+ | C. | Fe3+>Cl2>I2 | D. | I2>Cl2>Fe3+ |
 图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:
图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答: