题目内容
【题目】在相同温度下,0.01 mol/L的NaOH溶液和0.01 mol/L的盐酸相比较,下列说法正确的是( )
A.由水电离出的c(OH-)相等
B.由水电离出的c(H+)都是1.0×10-12 mol/L
C.两溶液的pH之和等于14
D.若将0.01 mol/L的盐酸换成同浓度的醋酸,对水的电离的影响不变
【答案】A
【解析】
水的电离方程式为:H2O![]() H++OH-,加入酸或碱后,增大氢离子或氢氧根离子浓度导致水的电离平衡向逆反应方向移动,即抑制水的电离,依据溶液中离子积常数计算水电离出离子的浓度。
H++OH-,加入酸或碱后,增大氢离子或氢氧根离子浓度导致水的电离平衡向逆反应方向移动,即抑制水的电离,依据溶液中离子积常数计算水电离出离子的浓度。
A.温度一定,0.01 mol/L的NaOH溶液和0.01 mol/L的盐酸对水的电离程度的抑制相同,故二者溶液中水电离出的氢离子和氢氧根离子浓度相同,故A正确;
B.温度一定时,两溶液中水的电离程度相同,0.01 mol/L的NaOH溶液中水电离出的c(H+)水=![]() ,0.01 mol/L的盐酸中水电离出的c(H+)水=c(OH-)水=
,0.01 mol/L的盐酸中水电离出的c(H+)水=c(OH-)水=![]() ,但温度不确定,KW不一定等于1×10-14,故B错误;
,但温度不确定,KW不一定等于1×10-14,故B错误;
C.0.01 mol/L的盐酸pH=-lg c(H+)=2,温度不确定,因此0.01 mol/L的NaOH溶液中c(H+)无法计算,无法计算溶液pH,故C错误;
D.醋酸为弱电解质,相同浓度盐酸和醋酸溶液中c(H+)不同,对水的电离抑制程度不同,故D错误;
故答案为:A。

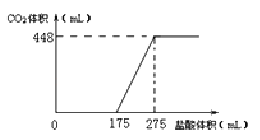
【题目】“中和滴定”原理在实际生产生活中应用广泛。用![]() 可定量测定CO的含量,该反应原理为
可定量测定CO的含量,该反应原理为![]() ,其实验步骤如下:
,其实验步骤如下:
①取200 mL(标准状况)含有CO的某气体样品通过盛有足量![]() 的硬质玻璃管中在170℃下充分反应:
的硬质玻璃管中在170℃下充分反应:
②用酒精溶液充分溶解产物![]() ,配制100 mL溶液;
,配制100 mL溶液;
③量取步骤②中溶液20.00 mL于锥形瓶中,然后用![]() 的
的![]() 标准溶液滴定,发生反应为
标准溶液滴定,发生反应为![]() 。消耗标准
。消耗标准![]() 溶液的体积如表所示。
溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 1.10 | 1.50 | 2.40 |
滴定后读数/mL | 21.00 | 21.50 | 22.50 |
(1)步骤②中配制100 mL待测液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和________。
(2)![]() 标准液应装在________(填“酸式”“碱式”)滴定管中。
标准液应装在________(填“酸式”“碱式”)滴定管中。
(3)指示剂应选用________,判断达到滴定终点的现象是________。
(4)气体样品中CO的体积分数为________(已知气体样品中其他成分不与![]() 反应)
反应)
(5)下列操作会造成所测CO的体积分数偏大的是________(填字母)。
a.滴定终点时仰视读数
b.滴定前尖嘴外无气泡,滴定后有气泡
C.配制100 mL待测溶液时,有少量溅出。
d.锥形瓶用待测溶液润洗
【题目】甲醇水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇水蒸气重整制氢的部分反应过程如图所示:
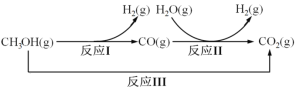
(1)已知一定条件下
反应I:CH3OH(g)==CO(g)+2H2(g) ΔH1=+90.7kJ/mol
反应III:CH3OH(g)+H2O(g) =CO2(g)+3H2(g) ΔH3=+49.5kJ/mol
该条件下反应II的热化学方程式是___。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率见图。
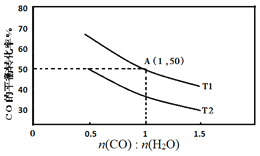
①比较T1、T2的大小,并解释原因___。
②A点对应的化学平衡常数是___。
③T1温度时,按下表数据开始反应建立平衡。
CO | H2O | H2 | CO2 | |
起始浓度(mol/L) | 2 | 1 | 0 | 0 |
t时刻浓度(mol/L) | 1.2 | 0.2 | 0.8 | 0.8 |
反应进行到t时刻时,判断v(正)、v(逆)的大小关系为:v(正)__v(逆)(填“>”“<”或“=”)。
④当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是___。
(3)在经CO2饱和处理的KHCO3电解液中,电解活化CO2可以制备乙醇,原理如图所示。
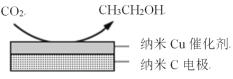
①阴极的电极反应式是___。
②从电解后溶液中分离出乙醇的操作方法是___。