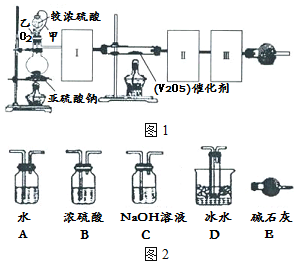
题目内容
3.以下我国古代的制作或技术涉及到化学反应的是( )| A. |  烧制陶罐 | B. |  雕刻石雕 | C. |  水车灌溉 | D. |  预报地震 |
分析 A.烧制陶罐生成硅酸盐;
B.雕刻石雕没有新物质生成;
C.水车灌溉没有新物质生成;
D.预报地震没有新物质生成.
解答 解:A.烧制陶罐生成硅酸盐,有新物质生成,属于化学变化,故A正确;
B.雕刻石雕没有新物质生成,属于物理变化,故B错误;
C.水车灌溉没有新物质生成,属于物理变化,故C错误;
D.预报地震没有新物质生成,属于物理变化,故D错误.
故选A.
点评 本题考查物理变化与化学变化的区别与联系,涉及化学反应与生活、生产的考查,为高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.只用一种试剂就能将Na2SiO3、Na2CO3、MgCl2、Ba(HCO3)2四种无色溶液区别开来,这种试剂是( )
| A. | 氢氧化钠溶液 | B. | 澄清石灰水 | C. | 2 mol/L 盐酸 | D. | 2 mol/L 硫酸 |
18. 25℃时,电离平衡常数:
25℃时,电离平衡常数:
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是a,b,d,c(填编号).
(2)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程pH变化如图,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH大,酸性强,电离平衡常数大,稀释后,HX溶液中水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是HX酸性强于CH3COOH,稀释后c(H+)小于CH3COOH溶液中的c(H+),所以对水的抑制能力减弱;
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=
9.9×10-7mol/L(填准确数值).
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 (25℃) | 1.8×10-5 | 3.0×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是a,b,d,c(填编号).
(2)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程pH变化如图,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH大,酸性强,电离平衡常数大,稀释后,HX溶液中水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是HX酸性强于CH3COOH,稀释后c(H+)小于CH3COOH溶液中的c(H+),所以对水的抑制能力减弱;
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=
9.9×10-7mol/L(填准确数值).
8.下列电子式书写不正确的是( )
| A. |  | B. |  | C. |  | D. |  |
15.分子式为C5H10O2,且可以发生水解反应的同分异构体有( )种.
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
13.关于电解氯化钠溶液,下列叙述正确的是( )
| A. | 电解时在正极得到氯气,在负极得到金属钠 | |
| B. | 若在正极附近有黄绿色的气体产生 | |
| C. | 若在负极附近的溶液中滴入酚酞溶液,溶液呈无色 | |
| D. | 电解一段时间后,将电解液全部转移到烧杯中,充分搅拌后溶液呈中性 |