题目内容
【题目】下面是同学们熟悉的物质:
①O2 ②H2O2 ③MgCl2 ④H2SO4 ⑤Na2CO3⑥NH4Cl ⑦CO2 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,属于共价化合物的是__(填序号,下同);只含有离子键的是__;不含化学键的是__。
(2)写出下列物质的结构式:
①O2__;②H2O2__;⑦CO2__。
(3)写出下列物质的电子式
⑥NH4Cl__;⑩NaOH__。
【答案】②④⑦ ③ ⑧ O=O H-O-O-H O=C=O 
![]()
【解析】
(1)共价化合物是指只含共价键的化合物,H2O2和H2SO4以及CO2中只含共价键,并且属于化合物,所以属于共价化合物的有②④⑦;Na2CO3,NH4Cl,Na2O2以及NaOH中既含有离子键又含有共价键,只有③MgCl2只含有离子键;稀有气体分子都是单原子分子,不含共价键,因此⑧不含共价键;
(2)结构式中用短线表示共用电子对,O2中的O原子之间有两个共用电子对,结构式为O=O;H2O2中,两个H原子分别与一个O原子之间有一个共用电子对,O原子之间还有一个共用电子对,结构式为H-O-O-H;CO2中,C与每个O原子之间都有两个共用电子对,结构式为O=C=O;
(3)NH4Cl是离子化合物,其中包含离子键以及![]() 中的共价键,电子式为
中的共价键,电子式为 ;NaOH也是离子化合物,其中包含离子键以及OH-中的共价键,电子式为
;NaOH也是离子化合物,其中包含离子键以及OH-中的共价键,电子式为![]() 。
。

【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。利用反应6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(g)可处理NO2。
7N2(g)+12H2O(g)可处理NO2。
(1)在2L的密闭容器中,2分钟内,上述反应混合物的物质的量增加了0.25mol,则2分钟内v(NH3)=______。
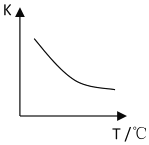
(2)该反应的化学平衡常数表达式K=______;已知该反应平衡常数(K)与温度(T)的关系如图所示,若升高温度,则v正反应______v逆反应(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均式量将______(填“变大”、“变小”或“不变”)。
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)请写出上述pH变化的原因______。
(4)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是______(填编号)。
(5)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。______。
【题目】一定条件下,2SO2(g)+O2(g)![]() 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的△H=-99 kJ·mol-1。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的△H=-99 kJ·mol-1。

(1)图中△H=___________kJ·mol-1(填数值);
(2)写出SO3(g)分解成SO2(g)和O2(g)的热化学方程式:_____________________。
(3)加入催化剂(V2O5)会使图中B点___________(填“升高”或“降低”)。
(4)从化学键角度分析,E表示的意义:______________________________。
(5)某工业生产实验数据如下:
温度 | 压强不同时SO2的转化率(%) | ||||
1.01×105 Pa | 5.05×105 Pa | 1.01×106 Pa | 5.05×106 Pa | 1.01×107 Pa | |
450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
你认为最适宜的条件是______________________。
(6)已知由S(s)生成3 mol SO3(g)共放出1185 kJ的热量,单质硫的燃烧热为_____kJ·mol-1。
(7)尾气SO2可以用氨水吸收除去。
已知25℃时,NH3·H2O 的Kb=1.8×10-5,H2SO3:Ka1=1.3×10-2、Ka2=6.2×10-8。
①若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=___________mol/L。
②将SO2 通入该氨水中,当c(OH-)降至1.0×10-7 mol/L时,溶液中的c(SO32-)/c(HSO3-)=___________。
【题目】某同学为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况下的体积),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)反应速率最大的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(2)反应速率最小的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(3)2~3min时间段内,以盐酸的浓度变化表示该反应的速率为__。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在盐酸中分别加入等体积的下列液体,你认为可行的是__(填序号)。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液



