题目内容
某同学利用下图装置可探究浓硫酸与木炭粉在加热条件下反应产生的三种气体产物,请填写下列空白: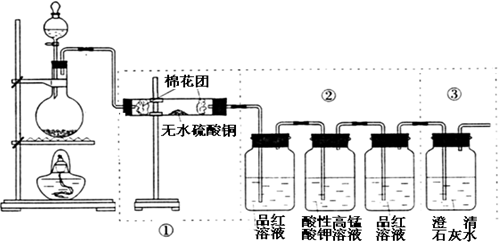
A、写出木炭粉与浓硫酸反应的化学方程式 ;
B、如果将装置中①、②、③三部分仪器的连接顺序改为②、①、③,则:可以检出的物质是 ;不能检出的物质是 ;
②中3个洗气瓶的现象依次为 、 、 ;
C、SO2可使氯水褪色,这是因为SO2具有 .(填序号)
A.氧化性 B.还原性 C.漂白性 D.酸性.

A、写出木炭粉与浓硫酸反应的化学方程式
B、如果将装置中①、②、③三部分仪器的连接顺序改为②、①、③,则:可以检出的物质是
②中3个洗气瓶的现象依次为
C、SO2可使氯水褪色,这是因为SO2具有
A.氧化性 B.还原性 C.漂白性 D.酸性.
考点:浓硫酸的性质实验
专题:实验设计题
分析:A、浓硫酸的强氧化性,加热条件下能够将木炭氧化成生成CO2、SO2和水;
B、对反应后产物气体的检验,应注意水蒸气的检验应在第一步,若先将气体通过溶液,则无法判断混合气体中是否存在水蒸气;
C、二氧化硫具有还原性,能够被氯气氧化,二氧化硫表现了还原性.
B、对反应后产物气体的检验,应注意水蒸气的检验应在第一步,若先将气体通过溶液,则无法判断混合气体中是否存在水蒸气;
C、二氧化硫具有还原性,能够被氯气氧化,二氧化硫表现了还原性.
解答:
解:A、浓硫酸具有强氧化性,在加热的条件下,能把木炭氧化生成CO2、SO2和水,反应的化学方程式为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
B、如果将装置中①、②、③三部分仪器的连接顺序改为②、①、③,无水CuSO4是用来检验水蒸气的存在,若混合气体先通过溶液,则会带出水蒸气,则无法判断使白色的无水CuSO4变蓝色的水蒸气来自哪里,因此答案为:SO2、CO2;H2O;②中3个洗气瓶的现象依次为:品红褪色,证明二氧化硫存在;高锰酸钾溶液颜色变浅,除去二氧化硫;品红不褪色,检验SO2是否除尽,
故答案为:SO2、CO2;H2O;品红褪色;高锰酸钾溶液颜色变浅;品红不褪色;
C、氯气具有强氧化性,而二氧化硫具有还原性,二者能够发生氧化还原反应,二氧化硫反应中被氧化,表现了还原性,所以B正确,
故答案为:B.
| ||
故答案为:C+2H2SO4(浓)
| ||
B、如果将装置中①、②、③三部分仪器的连接顺序改为②、①、③,无水CuSO4是用来检验水蒸气的存在,若混合气体先通过溶液,则会带出水蒸气,则无法判断使白色的无水CuSO4变蓝色的水蒸气来自哪里,因此答案为:SO2、CO2;H2O;②中3个洗气瓶的现象依次为:品红褪色,证明二氧化硫存在;高锰酸钾溶液颜色变浅,除去二氧化硫;品红不褪色,检验SO2是否除尽,
故答案为:SO2、CO2;H2O;品红褪色;高锰酸钾溶液颜色变浅;品红不褪色;
C、氯气具有强氧化性,而二氧化硫具有还原性,二者能够发生氧化还原反应,二氧化硫反应中被氧化,表现了还原性,所以B正确,
故答案为:B.
点评:本题考查了浓硫酸和木炭反应、生成物的检验,题目难度不大,该题是一道综合性实验题,试题基础性强,难易适中,侧重对学生能力的考查;本题有利于培养学生综合分析、归纳和总结问题的能力,有利于提高学生的实验设计能力,有利于调动学生的学习兴趣,提高学生的学习积极性.

练习册系列答案
相关题目
有一澄清透明的溶液,只可能含有大量的Fe3+、Fe2+、H+、Al(OH)4-、Al3+、CO32-、NO3-七种离子中的几种,向该溶液中逐滴加入一定量1mol/L NaOH溶液的过程中,开始没有沉淀,而后才有沉淀.则下列判断正确的是( )
| A、溶液中可能含有Al(OH)4- |
| B、溶液中可能含有NO3- |
| C、溶液中一定不含Fe2+和Fe3+ |
| D、溶液中可能含有Fe3+,但一定不含Fe2+ |
下列物质中能与钠、氢氧化钠、碳酸氢钠都反应的是( )
| A、苯酚 |
| B、HCOOCH3 |
| C、C2H5OH |
| D、HCOOH |
古语道:“人要实,火要虚”.此话的意思是说:做人必须脚踏实地,事业才能有成;燃烧固体燃料需要架空,燃烧才能更旺.从燃烧的条件看,“火要虚”的实质是( )
| A、增大可燃物的热值 |
| B、提高空气中氧气的含量 |
| C、提高可燃物的着火点 |
| D、增大可燃物与空气的接触面积 |



