题目内容
5.(1)某金属元素R,其硝酸盐分子式为R(NO3)n,摩尔质量为M,在t℃时该盐的饱和溶液的溶解度为Sg,密度为 dg/ml.则此温度下溶液的NO3-的物质的量浓度为$\frac{1000ndS}{M(100+S)}$mol/L.(2)为了除去KCl溶液中的少量MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C三种试剂,按下列步骤实验:

(3)写出三种试剂的化学式:ABa(OH)2、BK2CO3、CHCl
(4)若某氯化钠溶液中含有少量的CaCl2,某学生用过量的Na2CO3使Ca2+离子转化为沉淀而除去,确认Na2CO3已过量的实验方法是沉淀反应后,用试管取出上层清液,再加入氯化钙溶液,若生成白色沉淀,则可以认为碳酸钠已经过量.
分析 (1)根据w=$\frac{S}{100+S}$计算出该饱和溶液的质量分数,然后根据c=$\frac{1000ρw}{M}$计算出该溶液中R(NO3)n的浓度,再计算出NO3-的物质的量浓度;
(2)除去KCl溶液中的少量MgCl2、MgSO4,由流程可知,先加Ba(OH)2除去Mg2+、SO42-,再加K2CO3除去过量Ba(OH)2,最后加盐酸,以此来解答;
(3)(2)分析可知ABC的化学式;
(4)碳酸钠过量时,再加入氯化钙会出现白色沉淀.
解答 解:(1)在t℃时该盐的饱和溶液的溶解度为Sg,则溶液中R(NO3)n的质量分数为:$\frac{S}{100+S}$,
该溶液中R(NO3)n的浓度为:$\frac{1000×d×\frac{S}{100+S}}{M}$mol/L=$\frac{1000dS}{M(100+S)}$mol/L,
则此温度下溶液的NO3-的物质的量浓度为:c(NO3-)=n•c[R(NO3)n]=$\frac{1000dS}{M(100+S)}$mol/L×n=$\frac{1000ndS}{M(100+S)}$mol/L,
故答案为:$\frac{1000ndS}{M(100+S)}$;
(2)除去KCl溶液中的少量MgCl2、MgSO4,由流程可知,先加试剂A为Ba(OH)2除去Mg2+、SO42-,再加试剂B为K2CO3除去过量Ba(OH)2,过滤后,最后加试剂C为盐酸(HCl),得到纯净的KCl溶液,
(3)分析可知A为Ba(OH)2,B为K2CO3,C为盐酸,
故答案为:Ba(OH)2;K2CO3;HCl;
(4)碳酸钠可以和氯化钙反应生成碳酸钙白色沉淀和氢氧化钠,碳酸钠过量时,氯化钙会完全反应,可以再加入氯化钙检验碳酸钠是否过量,即沉淀反应后,用试管取出上层清液,再加入氯化钙溶液,若生成白色沉淀,则可以认为碳酸钠已经过量,
故答案为:沉淀反应后,用试管取出上层清液,再加入氯化钙溶液,若生成白色沉淀,则可以认为碳酸钠已经过量;
点评 本题考查了物质的量浓度计算、混合物分离提纯、物质的除杂和净化,题目难度中等,注意明确相对密度的含义及计算方法,熟练掌握物质的量浓度的概念及溶质质量分数与物质的量浓度的关系,把握流程中的反应、除杂试剂的选择及除杂原则为解答的关键.

 阅读快车系列答案
阅读快车系列答案| A. | 标准状况下,22.4L的CCl4中含CCl4分子数为NA | |
| B. | 5.6g 铁和6.4g 铜分别与0.1mol 氯气完全反应,转移的电子数相等 | |
| C. | 0.1mol•L-1MgCl2溶液中含Cl-数为0.2NA | |
| D. | 3.9g Na2O2晶体中含有的离子总数为0.2NA |
| A. | 0~5min,SO2的生成速率v(SO2)=0.12mol•L-1•min-1 | |
| B. | 若起始时充入3 mol SO3,起始时SO3分解速率不变 | |
| C. | 若某时刻消耗了1 molSO3同时生成了0.5molO2,则表明该反应达到了平衡状态 | |
| D. | 达到平衡时,SO2和SO3的浓度相等 |
| A. | 甲烷 | B. | 甲苯 | C. | 丙炔 | D. | 戊烯 |
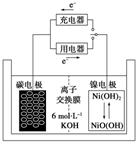 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时电池正极的电极反应为:NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| B. | 放电时K+移向负极 | |
| C. | 放电时电池负极的电极反应为H2-2e-═2H+ | |
| D. | 该电池充电时将碳电极与电源的正极相连 |
| A. | NaCl溶液在电流的作用下电离出Na+ | |
| B. | Na可以在氯气中燃烧,会冒白烟,火焰为黄色 | |
| C. | 氨水呈弱碱性,故NH3是弱电解质 | |
| D. | 溶于水电离出氢离子的化合物都是酸 |
 美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子(如图所示),就像一尊释迦牟尼佛.因而称为释迦牟尼分子(所有原子在同一平面).有关该有机分子的说法不正确的是( )
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子(如图所示),就像一尊释迦牟尼佛.因而称为释迦牟尼分子(所有原子在同一平面).有关该有机分子的说法不正确的是( )| A. | 该有机物属于苯的同系物 | B. | 该有机物属于芳香烃 | ||
| C. | 该有机物分子中含有22个碳原子 | D. | 该有机物一氯代物只有10种 |
| A. | 用长颈漏斗分离出乙酸与乙醇反应的产物 | |
| B. | 用向上排空气法收集铜粉与稀硝酸反应产生的NO | |
| C. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| D. | 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 |
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | 0.1 mol•L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 在溶质为KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl- |