��Ŀ����
(8��)ϡHNO3��п��Ӧ�Ļ�ѧ����ʽ���£�
4Zn + 10 HNO3 �� 4Zn(NO3)2 +N2O��+5H2O
(1)�����������ѧ����ʽ�е���ת�Ƶķ������Ŀ��
(2)�÷�Ӧ�л�ԭ��������������������ԭ��������������������ÿ2 mol Zn�μӷ�Ӧ��ת�Ƶĵ�����������������
(3)������Ӧ�У�HNO3û��ȫ���μ�������ԭ��Ӧ��û�вμ�������ԭ��Ӧ������������������ʵ���֮������������������������ ��
���𰸡�
(8��)(1)  (2��)
(2��)
(2)Zn (1��) N2O(1��) 4NA (2��) (3)4:5(2��)
������������������ԭ��Ӧ���й��жϺͼ��㡣
��1�����ݷ�Ӧ�ķ���ʽ��֪��пԪ�صĻ��ϼ۴�0�����ߵ���2�ۣ�ʧȥ2�����ӣ�����ԭ����������п��������������е�Ԫ�صĻ��ϼ۴ӣ�5�۽��͵���1�ۣ��õ�4�����ӣ�������������������N2O�ǻ�ԭ�����˸��ݵ��ӵĵ�ʧ�غ��֪����ʾΪ
 ��
��
��2�����ݷ�Ӧ�ķ���ʽ��֪��2 mol Zn�μӷ�Ӧ��ת�Ƶĵ��ӵ����ʵ�����4mol��������4NA ����
��3�����ݷ���ʽ��֪��û�вμ�������ԭ��Ӧ������������������ʵ���֮����4�U5��

��ϰ��ϵ�д�
 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
�����Ŀ
 A��B��C��D�ֱ���HNO3��Ba��NO3��2��NH4Cl��NaOH������Һ�е�һ�֣���������һ�ֳ�����ҺX������ͼ��ʾ�ķ������ɽ�����һһȷ������ش��������⣺
A��B��C��D�ֱ���HNO3��Ba��NO3��2��NH4Cl��NaOH������Һ�е�һ�֣���������һ�ֳ�����ҺX������ͼ��ʾ�ķ������ɽ�����һһȷ������ش��������⣺
 CuO
CuO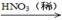 Cu(NO3)2
Cu(NO3)2