题目内容
【题目】CO2是目前大气中含量最高的一种温室气体,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。己知部分反应的热化学方程式如下:
CH3OH(g)+ 3/2O2(g) =CO2(g)+2H2O(1) ΔH1=a kJ·mol1
H2(g)+1/2O2(g) =H2O(1) ΔH2=b kJ·mol1
H2O(g) = H2O(l) ΔH3=c kJ·mol1
则 CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=_______kJ·mol1
CH3OH(g)+H2O(g) ΔH=_______kJ·mol1
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g) ΔH,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。
2CO(g) ΔH,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。
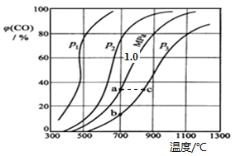
回答下列问题:
①压强p1、p2、p3的大小关系是______;Ka 、 Kb 、 Kc 为a、b、c三点对应的平衡常数,则其大小关系是______。
②900℃、1.0 MPa时,足量碳与a molCO2反应达平衡后,CO2的转化率为________ (保留三位有效数字),该反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
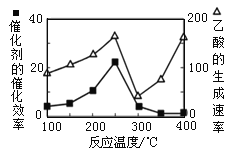
(3)以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2 和CH4 直接转化成乙酸,CO2(g)+CH4(g) ![]() CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300 ℃时,乙酸的生成速率降低的主要原因是_______。
CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300 ℃时,乙酸的生成速率降低的主要原因是_______。
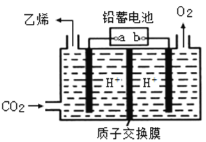
(4)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图所示,电解所用电极材料均为惰性电极。阴极上的电极反应式为__________;每生成0.5mol乙烯,理论上需消耗铅蓄电池中_____mol硫酸。
【答案】(3b-a-c ) p1<p2<p3 Ka=Kb<Kc 66.7% (或0.667) 3.2 Mpa 催化剂的催化效率降低 2CO2+12H++12e- = CH2=CH2 +4H2O 6
【解析】
(1)第二个方程式2倍减去第一个方程式,再减去第三个方程式。
(2)①根据平衡移动来分析压强关系,根据温度变化来判断平衡常数;②分别假设计算出CO、CO2物质的量,再计算CO2的转化率和平衡常数。
(3)根据图中信息分析出催化剂的催化效率降低。
(4)根据分析,左侧CO2转化为乙烯,化合价降低,得到电子,根据Pb + PbO2+ 2H2SO4=2PbSO4+ 2H2O分析电子转移与消耗硫酸关系。
(1)第二个方程式2倍减去第一个方程式,再减去第三个方程式得到CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=(3b-a-c) kJ·mol1;故答案为:(3b-a-c)。
CH3OH(g)+H2O(g) ΔH=(3b-a-c) kJ·mol1;故答案为:(3b-a-c)。
(2)①从700℃分析,从下到上,CO体积分数增大,则说明平衡正向移动,该反应是体积增大的反应,即减小压强,因此压强p1、p2、p3的大小关系是p1<p2<p3;Ka、Kb、Kc为a、b、c三点对应的平衡常数,a、b温度相等,则平衡常数相等,b、c压强相同,温度不同,温度升高,CO体积分数增大,平衡正向移动,平衡常数变大,因此其大小关系是Ka=Kb<Kc;故答案为:p1<p2<p3;Ka=Kb<Kc。
②900℃、1.0 MPa时,足量碳与a molCO2反应达平衡后,CO的体积分数为为80%,则CO2的体积分数为20%,假设平衡时CO物质的量为0.8mol,CO2物质的量为0.2mol,则CO2改变量为0.4mol,因此CO2的转化率为![]() ,该反应的平衡常数
,该反应的平衡常数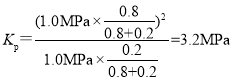 ;故答案为:66.7%(或0.667);3.2 Mpa。
;故答案为:66.7%(或0.667);3.2 Mpa。
(3)根据图中信息,250~300 ℃时,乙酸的生成速率降低的主要原因是催化剂的催化效率降低;故答案为:催化剂的催化效率降低。
(4)以铅蓄电池为电源可将CO2转化为乙烯,其原理如图所示,电解所用电极材料均为惰性电极。根据分析,左侧CO2转化为乙烯,化合价降低,得到电子,为阴极,因此阴极上的电极反应式为2CO2+12H++12e- = CH2=CH2+4H2O;根据Pb + PbO2+ 2H2SO4=2PbSO4+ 2H2O分析,转移2mol电子,反应2mol硫酸,每生成0.5mol乙烯,转移6mol电子,所以理论上需消耗铅蓄电池中6 mol硫酸;故答案为:2CO2+12H++12e- = CH2=CH2+4H2O;6。