题目内容
2.下列电池工作时,O2在正极放电的是( )| A. |  甲醇燃料电池 | B. |  镍镉电池 镍镉电池 | C. |  锌锰电池 | D. |  铅蓄电池 铅蓄电池 |
分析 电池工作时,O2在正极放电,则正极上氧气得到电子,发生O2+4H++4e-=2H2O或O2+2H2O+4e-=4OH-,以此来解答.
解答 解:A.甲醇燃料电池中,如果电解质溶液是酸性,则正极反应式为O2+4H++4e-=2H2O,如果电解质是碱性,则正极反应式为O2+2H2O+4e-=4OH-,故A正确;
B.镍镉电池放电正极反应为2NiOOH+2H2O+2e-=2Ni(OH)2+2OH-,负极反应为Cd+2OH--2e-=Cd(OH)2,所以不符合题意,故B错误;
C.锌锰干电池中电极反应式,负极反应为Zn-2e-═Zn2+,正极反应为2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O,所以不符合题意,故C错误;
D.铅蓄电池放电时负极电极反应为Pb-2e-+SO42-=PbSO4 ,正极电极反应为PbO2+2e-+4H++SO42-=PbSO4+2H2O,所以不符合题意,故D错误;
故选A.
点评 本题考查电极反应式的书写,明确原电池和电解池各个电极上发生的反应是解本题关键,书写电极反应式要结合电解质溶液酸碱性,要熟练掌握,题目难度中等.

练习册系列答案
相关题目
20.25℃、101KPa时,agNH3与bgCH4的体积相同,下列叙述不正确的是( )
| A. | NH3、CH4的分子数之比为1:1 | B. | NH3、CH4两种气体的密度之比为a:b | ||
| C. | NH3、CH4的摩尔质量之比为17:16 | D. | NH3、CH4的物质的量之比为a:b |
1.下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A) | |
| B. | 0.2 mol•L-1 CH3COONa溶液与0.1 mol•L-1盐酸等体积混合后的酸性溶液中:>c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+) | |
| C. | 室温下,向100ml0.5mol/L的Na2CO3溶液中加入0.05molCaO,溶液中增大$\frac{c(O{H}^{-})}{c(H{{C}_{3}}^{-})}$ | |
| D. | 0.1 mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
10.实验室进行过滤和蒸发操作时,都要用到的仪器是( )
| A. | 玻璃棒 | B. | 量筒 | C. | 蒸发皿 | D. | 酒精灯 |
17.紫草宁具有多种生物活性,能抗菌、消炎、抗肿瘤等.合成紫草宁的部分工艺流程如下:
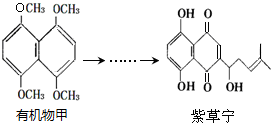
下列说法正确的是( )

下列说法正确的是( )
| A. | 有机物甲中共有两种化学环境下的氢 | |
| B. | 紫草宁的分子式为C16H18O5 | |
| C. | 紫草宁有8个不饱和度 | |
| D. | 在一定条件下,紫草宁可以发生氧化反应、还原反应、取代反应、加聚反应 |
14.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑.若氧化产物比还原产物多0.7mol,则下列判断正确的是( )
| A. | 生成15.68LN2(标准状况) | |
| B. | 有0.1molKNO3被氧化 | |
| C. | 转移电子的物质的量为0.25mol | |
| D. | 被氧化的N原子的物质的量为1.5mol |
11.下列各原子或离子的电子排列式错误的是( )
| A. | Na+ 1s22s22p6 | B. | F?1s22s22p6 | C. | N3+ 1s22s22p6 | D. | O 1s22s22p4 |
12.实验室用高锰酸钾加热制取氧气主要有以下步聚:
a.加热盛有药品的试管;
b.向试管中加入药品;
c.检查装置的气密性;
d.用排水法收集气体;
e.停止加热;
f.将导气管从水槽中取出
正确的操作顺序是( )
a.加热盛有药品的试管;
b.向试管中加入药品;
c.检查装置的气密性;
d.用排水法收集气体;
e.停止加热;
f.将导气管从水槽中取出
正确的操作顺序是( )
| A. | cbadef | B. | dacfbe | C. | badcfe | D. | cbadfe |