题目内容
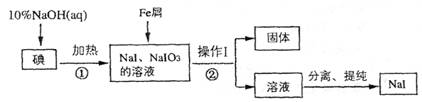
碘化钠是实验室中常用的分析试剂,工业上用铁屑还原法制备NaI的流程如图:

请回答下列问题:
(1)判断反应①中碘是否反应完全的方法是
(2)操作I的名称是 ;
(3)反应①的离子方程式为
(4)反应②中NaIO3被Fe单质还原为NaI,同时生成Fe(OH)3,该反应的化学方程式是 ;在该反应中若有99g NaIO3被还原,则转移电子的物质的量为 mol.

请回答下列问题:
(1)判断反应①中碘是否反应完全的方法是
(2)操作I的名称是
(3)反应①的离子方程式为
(4)反应②中NaIO3被Fe单质还原为NaI,同时生成Fe(OH)3,该反应的化学方程式是
分析:由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,操作I为过滤,固体为氢氧化铁,②过滤后溶液中主要含NaI,分离、提纯得到NaI,以此来解答.
解答:解:由制备流程可知,碘与NaOH溶液反应生成NaI、NaIO3,加入Fe与NaIO3发生氧化还原反应生成NaI、氢氧化铁,操作I为过滤,固体为氢氧化铁,②过滤后溶液中主要含NaI,分离、提纯得到NaI,
(1)淀粉遇碘变蓝,反应后加淀粉无现象即可说明反应结束,则判断反应①中碘是否反应完全的方法为取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全,(或取少量反应后的溶液于试管中,滴入几滴CCl4,振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全),
故答案为:取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全,(或取少量反应后的溶液于试管中,滴入几滴CCl4,振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全);
(2)由上述分析可知,操作I为过滤,故答案为:过滤;
(3)反应①的离子方程式为3I2+6OH-=5I-+IO3-+3H2O,故答案为:3I2+6OH-=5I-+IO3-+3H2O;
(4)反应②的化学方程式是2Fe+NaIO3+3H2O=2Fe(OH)3↓+NaI,若有99g NaIO3被还原,转移电子为
×[(+5)-(-1)]=3mol,
故答案为:2Fe+NaIO3+3H2O=2Fe(OH)3↓+NaI;3.
(1)淀粉遇碘变蓝,反应后加淀粉无现象即可说明反应结束,则判断反应①中碘是否反应完全的方法为取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全,(或取少量反应后的溶液于试管中,滴入几滴CCl4,振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全),
故答案为:取少量反应后的溶液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已反应完全;反之,碘未反应完全,(或取少量反应后的溶液于试管中,滴入几滴CCl4,振荡、静置,若下层液体呈无色,证明碘已反应完全;若下层液体呈紫红色,证明碘未反应完全);
(2)由上述分析可知,操作I为过滤,故答案为:过滤;
(3)反应①的离子方程式为3I2+6OH-=5I-+IO3-+3H2O,故答案为:3I2+6OH-=5I-+IO3-+3H2O;
(4)反应②的化学方程式是2Fe+NaIO3+3H2O=2Fe(OH)3↓+NaI,若有99g NaIO3被还原,转移电子为
| 99g |
| 198g/mol |
故答案为:2Fe+NaIO3+3H2O=2Fe(OH)3↓+NaI;3.
点评:本题考查物质制备实验,明确制备流程中发生的反应及操作为解答的关键,涉及氧化还原反应及碘的特性,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
 ________
________
