题目内容
(1)物质的量浓度相同的①氨水,②氯化铵,③碳酸氢铵,④硫酸氢铵四种溶液中[ ]大小顺序是________,溶液pH大小顺序是________.
]大小顺序是________,溶液pH大小顺序是________.
(2)在纯碱溶液中滴入酚酞,溶液变红.若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是________.其原因是(以离子方程式和简要文字说明)________.
答案:
解析:
解析:
|
(1)④>②>③>①,①>③>②>④;(2)有白色沉淀产生,溶液红色褪去, 导解:NH3·H2O为弱电解质,其余三种为强电解质;氯化铵水解使[ |

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
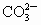 +H2O
+H2O
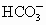 +OH-,故加入酚酞后溶液呈红色.加入BaCl2后:
+OH-,故加入酚酞后溶液呈红色.加入BaCl2后: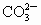 +Ba2+
+Ba2+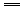 BaCO3↓,水解平衡左移,故溶液红色褪去.
BaCO3↓,水解平衡左移,故溶液红色褪去.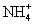 ]有所下降,碳酸氢铵双水解相互促进,使[
]有所下降,碳酸氢铵双水解相互促进,使[