题目内容
【题目】已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法中正确的是( ) 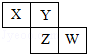
A.W的原子序数不可能是X的原子序数的3倍
B.Z元素可能是金属元素
C.W的气态氢化物的稳定性一定比Y的强
D.四种元素的原子有可能均能与氢原子形成18电子分子
【答案】D
【解析】解:X、Y、Z、W四种短周期主族元素,根据元素在周期表中的相对位置知,X和Y位于第二周期、Z和W位于第三周期,如果W是Cl元素,则X、Y、Z分别是N、O、S元素; 如果W是S元素,则X、Y、Z分别是C、N、P元素;
如果W是P元素,则X、Y、Z分别是B、C、Si元素;
A.如果W是P、X是B元素,则W原子序数是X的3倍,故A错误;
B.Z可能是P、Si元素,所以Z不可能为金属元素,故B错误;
C.N元素电负性大于S,则N元素氢化物稳定性大于S元素氢化物,故C错误;
D.若X、Y、Z、W分别是N、O、S、Cl元素,那么它们与H原子形成18电子的分子分别是N2H4、H2O2、H2S、HCl,故D正确;
故选D.

【题目】以铝灰(主要成分为Al、Al2O3 , 另有少量CuO、SiO2、FeO和Fe2O3杂质)为原料,可制得液体聚合氯化铝[Alm(OH)nCl3m﹣n],生产的部分过程如图所示(部分产物和操作已略去). 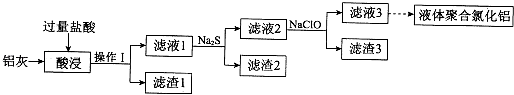
已知某些硫化物的性质如下表:
物质 | 性质 |
Fe2S3 Al2S3 | 在水溶液中不存在 |
FeS | 黑色,难溶于水,可溶于盐酸 |
CuS | 黑色,难溶于水,难溶于盐酸 |
(1)操作I是 . Al2O3与盐酸反应的离子方程式是 .
(2)滤渣2为黑色,该黑色物质的化学式是 .
(3)向滤液2中加入NaClO溶液至不再产生红褐色沉淀,此时溶液的pH约为3.7.NaClO的作用是 .
(4)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝.反应的化学方程式是 .
(5)将滤液3电解也可以得到液体聚合氯化铝.装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极). 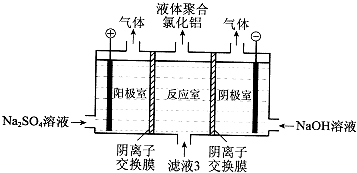
①写出阴极室的电极反应: .
②简述在反应室中生成聚合氯他铝的原理: .