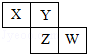
题目内容
【题目】下列说法中,正确的是( )
A. 第ⅠA族元素的金属性一定比ⅡA族元素的金属性强
B. 除短周期外,其他周期均有18种元素
C. 短周期中,同周期元素的离子半径从左到右逐渐减小
D. 主族是由短周期元素和长周期元素共同组成的族
【答案】D
【解析】
A.第ⅠA族元素的金属性不一定比ⅡA族元素的金属性强,如Li比Ca、Ba等金属的金属性弱,故A错误;
B.四、五周期有18种元素,第六、七周期有32种元素,故B错误;
C.核外电子层数越多,离子半径越大,同周期元素的离子半径,阳离子半径小于阴离子半径,故C错误;
D.副族元素与Ⅷ族不含短周期元素,除0族外,短周期元素和长周期元素共同组成的族称为主族,故D正确;
答案选D。

【题目】某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究. Ⅰ.产物种类探究
在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为中的一种或两种.
资料2:
硫酸/molL﹣1 | 黑色物质出现的温度/°C | 黑色物质消失的温度/°C |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
(1)由上述资料2可得出的正确结论是(选填下列字母编号) a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度>15molL﹣1
d.硫酸浓度越大,黑色物质出现越快,越难消失
(2)Cu与足量16molL﹣1浓硫酸反应时,在80°C以后,随着温度的逐渐升高,反应中硫酸铜的生成逐渐增加,而CuS却逐渐减少,到达250°C左右时,CuS在反应中完全消失的澄清溶液,CuS消失的化学方程式为 .
(3)Ⅱ.产物性质探究 Cu与浓H2SO4反应生成的CuSO4具有某些特定性质,一定浓度CuSO4溶液与NaHCO3溶液反应后生成蓝绿色颗粒状沉淀,沉淀可能是CuCO3 , Cu(OH)2 , 或者CuCO3与Cu(OH)2的混合物.
1)若沉淀是Cu(OH)2 , 生成沉淀的离子方程式是 .
2)为了进一步探究沉淀的成分,设计的实验装置如图:
实验操作步骤为
a.取沉淀样品100克于B中,检查装置的气密性
b.打开K1 , K3 , 关闭K2 , K4 , 通入足量空气
c.关闭K1 , K3 , 打开K2 , K4 , 充分反应
d.反应结束后,关闭K2 , 打开K1 , 再通入足量空气
e.测得装置D的质量增加了22g
①步骤b的作用是
②若沉淀样品为CuCO3和Cu(OH)2的混合物,则Cu(OH)2的质量分数为 , 若不进行步骤d,则会使测得Cu(OH)2的质量分数为(填“偏高”“无影响”“偏低”)