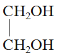题目内容
【题目】写出下列物质在水溶液中的电离方程式:
(1)HClO___________________________________________________
(2)Ba(NO3)2______________________________________________
A层:(3)NaHSO4____________________________________________
NH3·H2O_____________________________________________________
B层:(3)H2CO3______________________________________________
Fe(OH)3____________________________________________________
【答案】HClO![]() H++ClO- Ba(NO3)2=Ba2++2NO3- NaHSO4=Na++H++SO42- NH3·H2O
H++ClO- Ba(NO3)2=Ba2++2NO3- NaHSO4=Na++H++SO42- NH3·H2O![]() NH+4+OH- H2CO3
NH+4+OH- H2CO3![]() H++HCO3- HCO3-
H++HCO3- HCO3-![]() H++CO32- Fe(OH)3
H++CO32- Fe(OH)3![]() Fe3++3OH-
Fe3++3OH-
【解析】
用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式,离子所带电荷数一般可根据它们在化合物中的化合价来判断,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,书写电离方程式时要先判断是强弱电解质,强电解质用“=”,而弱电解质用“![]() ”,据此分析判断。
”,据此分析判断。
(1)HClO为弱电解质,其电离方程式为:HClO![]() H++ClO-,
H++ClO-,
故答案为:HClO![]() H++ClO-;
H++ClO-;
(2)Ba(NO3)2为强电解质,其电离方程式为:Ba(NO3)2=Ba2++2NO3-,
故答案为:Ba(NO3)2=Ba2++2NO3-;
A层:(3)NaHSO4为强电解质,其电离方程式为:NaHSO4=Na++H++SO42-,
故答案为:NaHSO4=Na++H++SO42-;
(4)NH3·H2O为弱电解质,其电离方程式为:NH3·H2O![]() NH+4+OH-,
NH+4+OH-,
故答案为:NH3·H2O![]() NH+4+OH-;
NH+4+OH-;
B层:(3)H2CO3为二元弱酸其电离方程式分两步进行,分别为:H2CO3![]() H++HCO3-,HCO3-
H++HCO3-,HCO3-![]() H++CO32-,
H++CO32-,
故答案为:H2CO3![]() H++HCO3-,HCO3-
H++HCO3-,HCO3-![]() H++CO32-;
H++CO32-;
(4)Fe(OH)3为弱电解质,其电离方程式为:Fe(OH)3![]() Fe3++3OH-,
Fe3++3OH-,
故答案为:Fe(OH)3![]() Fe3++3OH-。
Fe3++3OH-。