题目内容
关于如图所示装置的叙述,正确的是( )


| A、铜片上有气泡产生 |
| B、铜片质量逐渐减少 |
| C、电流从锌片经导线流向铜片 |
| D、氢离子在铜片表面被氧化 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该装置中,锌易失电子作负极,铜作正极,负极上失电子发生氧化反应,氢离子在正极上得电子生成氢气发生还原反应,电子从负极沿导线流向正极.
解答:
解:A.锌易失电子作负极,铜作正极,正极上氢离子得电子生成氢气,所以气泡在铜片上产生,故A正确;
B.铜片上氢离子得电子生成氢气而不是铜失电子发生氧化反应,所以铜片质量不变,故B错误;
C.锌易失电子作负极,铜作正极,电流从铜经导线到锌,故C错误;
D.氢离子在铜表面被还原,故D错误;
故选A.
B.铜片上氢离子得电子生成氢气而不是铜失电子发生氧化反应,所以铜片质量不变,故B错误;
C.锌易失电子作负极,铜作正极,电流从铜经导线到锌,故C错误;
D.氢离子在铜表面被还原,故D错误;
故选A.
点评:本题考查了原电池原理,明确正负极的判断方法、电子的流向、正负极发生的反应即可解答,题目难度不大.

练习册系列答案
相关题目
在实验室中,对下列事故或药品的处理正确的是( )
| A、有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 |
| B、金属钠着火燃烧时,用泡沫灭火器灭火 |
| C、酒精灯打翻着火,用水灭火 |
| D、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
能通过化学反应使溴水褪色,又能使酸性高锰酸钾溶液褪色的是( )
| A、苯 | B、乙烯 | C、甲烷 | D、乙烷 |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A、反应在t1 min内的平均速率为v(H2)=
| ||
| B、保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变 | ||
| C、保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol | ||
| D、温度升高至800℃,上述反应平衡常数为0.64,则正反应为放热反应 |
某温度下,将Cl2通入NaOH溶液,得到NaCl、NaClO、NaClO3的混合液,经测定ClO-、ClO3-的浓度之比为5:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )
| A、21:5 | B、11:3 |
| C、5:2 | D、4:1 |
下列物质的溶液能导电,但不属于电解质的是( )
| A、Ba(OH)2 |
| B、蔗糖 |
| C、Cl2 |
| D、HCl |
下列描述,其因果关系成立的是( )
| A、因为NH3的水溶液可以导电,所以NH3是电解质 |
| B、因为SO2可以使溴水褪色,所以SO2具有漂白性 |
| C、因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH |
| D、因为电解质溶于水后电离为离子,所以电解质在溶液中的反应实质是离子反应 |
已知A、B、C、D均是气体,反应A+B?C+D的能量变化如图所示,下列说法正确的是( )
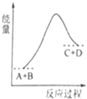

| A、当A的正反应速率与C的逆反应速率相同时处于平衡状态 |
| B、当A、B、C、D的浓度相同时,反应处于平衡状态 |
| C、反应物的总键能量低于生成物的总键能 |
| D、该反应是放热反应 |
下列离子方程式书写正确的是( )
| A、在100 mL 1 mol?L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
| B、在100 mL 2 mol?L-1的FeI2的溶液中通入标况下5.6 L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl- |
| C、向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
| D、向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |