题目内容
 2011年6月,云南曲靖陆良化工实业有限公司5000多吨工业废料铬渣非法倾倒导致当地严重污染.+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小.工业含铬废水的处理方法之一是将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的NaCl后进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去.
2011年6月,云南曲靖陆良化工实业有限公司5000多吨工业废料铬渣非法倾倒导致当地严重污染.+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小.工业含铬废水的处理方法之一是将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的NaCl后进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去.(已知:常温下Ksp Fe(OH)3=2.6×10-39,Ksp Cr(OH)3=6.0×10-31)
(1)若阳极铁质量减少16.8g,则理论上被还原的Cr2O72-的物质的量为
0.05
0.05
mol.(2)已知电解后的溶液中c(Fe3+)为2.6×10-13 mol?L-1,则溶液中Cr3+浓度为
6.0×10-5
6.0×10-5
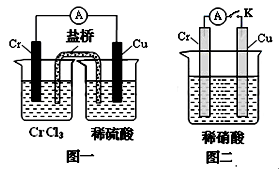
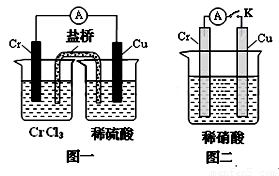
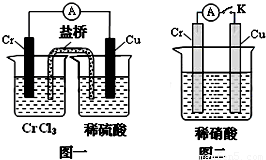
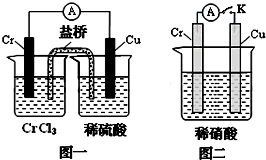
mol?L-1.(3)在下图装置中,观察到图一装置铜电极上产生大量的无色气泡,而在图二装置中当开关K断开时,铬电极无现象,K闭合时,铬电极上产生大量无色气体,并变成红棕色气体.根据上述现象试推测金属铬的两个重要化学性质
铬比铜活泼
铬比铜活泼
、铬在稀硝酸中可以发生钝化
铬在稀硝酸中可以发生钝化
.分析:(1)根据转移电子相等计算;
(2)先根据KspFe(OH)3和c(Fe3+)求出C(OH-),然后再根据C(OH-)和KspCr(OH)3求出c(Cr3+);
(3)由图1、2中原电池原理判断金属铬的活动性.
(2)先根据KspFe(OH)3和c(Fe3+)求出C(OH-),然后再根据C(OH-)和KspCr(OH)3求出c(Cr3+);
(3)由图1、2中原电池原理判断金属铬的活动性.
解答:解:(1)根据转移电子数相等计算,设被还原的Cr2O72-的物质的量是x,
×1=(6-3)×2×x,x=0.05mol,故答案为:0.05;
(2)溶液中c(OH-)=
mol/L=
mol/L,则溶液中c(Cr3+)=
mol/L=6.0×10-5mol/L,故答案为:6.0×10-5;
(3)由图1根据原电池原理知金属铬的活动性比铜强;而图2中铬电极上硝酸根离子得电子,则说明铬被稀硝酸氧化生成的氧化物阻止了铬进一步反应,即发生钝化现象,故答案为:铬比铜活泼,铬在稀硝酸中可以发生钝化.
| 16.8g |
| 56g/mol |
(2)溶液中c(OH-)=
| 3 |
| ||
| 3 | 1×1026 |
| 6.0×10-31 | |||
(
|
(3)由图1根据原电池原理知金属铬的活动性比铜强;而图2中铬电极上硝酸根离子得电子,则说明铬被稀硝酸氧化生成的氧化物阻止了铬进一步反应,即发生钝化现象,故答案为:铬比铜活泼,铬在稀硝酸中可以发生钝化.
点评:本题考查原电池原理、氧化还原反应、难溶电解质的溶解平衡等知识点,注意溶度积的有关计算,为易错点.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目