题目内容
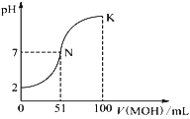
【题目】某可充电钠离子电池放电时工作原理如图所示,下列说法错误的是

A.放电时电势较低的电极反应式为:Fe[Fe(CN)6]+2Na++2e-=Na2Fe[(CN)6]
B.外电路中通过0.2 mol电子的电量时,负极质量变化为2.4 g
C.充电时,Mo箔接电源的正极
D.放电时,Na+从右室移向左室
【答案】A
【解析】
由原电池示意图可知,正极上发生还原反应,电解方程式为Fe[Fe(CN)6]+2Na+-2e-=Na2Fe[Fe(CN)6],负极发生氧化反应,电解方程式为2Mg+2Cl--4e-=[Mg2Cl2]2+,充电时,原电池的负极连接电源的负极,电极反应和放电时的相反,以此解答该题。
A.放电时,电势较低的电极为负极,负极失去电子,发生氧化反应,电极反应式为2Mg+2Cl--4e-=[Mg2Cl2]2+,A错误;
B.负极上Mg失电子发生氧化反应:2Mg+2Cl--4e-=[Mg2Cl2]2+,外电路中通过0.2 mol电子的电量时,负极质量变化为减少的金属镁0.1 mol,即质量变化2.4 g,B正确;
C.充电时,原电池的正极连接电源的正极,发生氧化反应,Mo箔接电源的正极,C正确;
D.放电时,阳离子Na+向负电荷较多的正极移动,所以放电时,Na+从右室移向左室,D正确;
故合理选项是A。

练习册系列答案
相关题目