题目内容
5.下列说法正确的是( )| A. | 将Ca(ClO)2、Na2SO3、FeCl3溶液蒸干可得到原溶质 | |
| B. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 | |
| C. | 在新制氯水中各微粒浓度的关系为:2c(Cl2)=c(ClO?)+c(Cl?)+c(HClO) | |
| D. | 用1L 0.2 mol•L-1NaOH溶液分别吸收0.1molSO2、0.1mol CO2,所得的两种溶液中酸根离子浓度大小关系是:c(SO32- )>c(CO32-)>c(HCO3-)>c(HSO3-) |
分析 A.根据物质水解产物的稳定性分析;
B.I2+2NaClO3═2NaIO3+Cl2反应中I2作还原剂;
C.根据氯水中存在的微粒判断;
D.碳酸钠的水解程度大于亚硫酸钠.
解答 解:A.Na2SO3易被氧气氧化为硫酸钠,Ca(ClO)2水解生成的HClO不稳定,FeCl3水解生成的HCl易挥发,所以将Ca(ClO)2、Na2SO3、FeCl3溶液蒸干不能得到原溶质,故A错误;
B.还原性强的能把还原性弱的置换出来,I2的还原性大于Cl2,则I2+2NaClO3═2NaIO3+Cl2能发生,故B错误;
C.氯水中存在Cl2、Cl?、ClO?、HClO,氯气没有全部与水发生反应,则不能确定氯气与Cl?、ClO?、HClO的浓度关系,故C错误;
D.碳酸钠的水解程度大于亚硫酸钠,水解程度越大,溶液中剩余的离子浓度越小,则c(SO32- )>c(CO32-),CO32-的水解程度大,则生成的HCO3-多,所以酸根离子浓度大小关系是:c(SO32- )>c(CO32-)>c(HCO3-)>c(HSO3-),故D正确.
故选D.
点评 本题考查盐类的水解以及元素化合物知识,题目难度中等,注意硫酸和盐酸的挥发性的不同,侧重于基础知识应用的考查.

练习册系列答案
相关题目
15. 室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )
室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )
 室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )
室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )| A. | Ⅱ表示的是滴定氨水的曲线,当V(HCI)=20 mL时,有:c(Cl-)>c(N${{H}_{4}}^{+}$)>c(H+)>c(OH-) | |
| B. | 当pH=7时,滴定氨水消耗的V(HCl)=20 mL,且c(N${{H}_{4}}^{+}$)=c(Cl-) | |
| C. | 滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 当滴定氨水消耗V(HCl)=10 mL时,有:2[c(OH-)-c(H+)]=c(N${{H}_{4}}^{+}$)-c(NH3•H2O) |
16.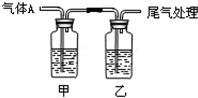 利用如图所示装置进行实验,有关现象和解释均正确的是( )
利用如图所示装置进行实验,有关现象和解释均正确的是( )
 利用如图所示装置进行实验,有关现象和解释均正确的是( )
利用如图所示装置进行实验,有关现象和解释均正确的是( )| 选项 | 足量 气体A | 甲中试剂 | 乙中试剂 | 现象 | 解释 |
| A | CO2 | Na2SiO3 | BaCl2 | 甲浑浊、乙澄清 | 酸性:HCl>H2CO3>H2SiO3 |
| B | Cl2 | 紫色石蕊 | Fe(SCN)2 | 开始均变红 | Cl2溶于水显酸性 |
| C | SO2 | 品红溶液 | KMnO4 | 均褪色 | SO2具有漂白性 |
| D | NH3 | AgNO3 | AlCl3 | 现象相同 | NH3•H2O电离出OH- |
| A. | A | B. | B | C. | C | D. | D |
13.电解NO制备NH4NO3,其工作原理如图所示,下列说法不正确的是( )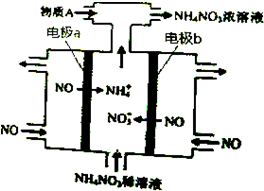

| A. | b极的电极反应为:NO-3e-+2H2O=NO3-+4H+ | |
| B. | 溶液中的H+由电极a处向电极b处迁移 | |
| C. | 电解过程总反应的化学方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3 | |
| D. | 为使电解产物全部转化为NH4NO3,需补充的物质A是NH3 |
20.25℃的四种溶液:①pH=2的CH3COOH溶液 ②pH=2的HCl溶液 ③pH=12的氨水 ④pH=12的NaOH溶液.有关上述溶液的比较中,正确的是( )
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| D. | 向溶液中加入100 mL水后,溶液的pH:③>④>①>② |
3.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 活性炭使糖浆脱色与次氯酸盐漂白纸浆的原理相同 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 新型能源生物柴油和矿物油主要化学成分相同 |

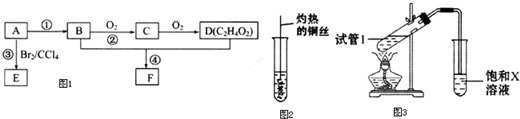
 .
. 、
、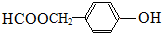 或
或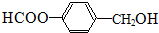 (任写一种).
(任写一种).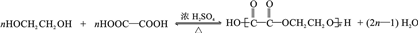 .
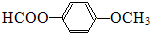
.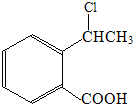 为原料制
为原料制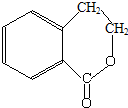 的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如图2:
的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如图2: ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.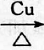 2CH3CHO+2H2O.
2CH3CHO+2H2O.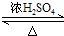 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.