题目内容
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
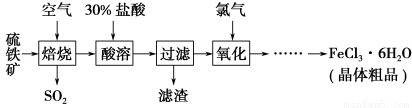
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)??2SO3(g),该反应的平衡常数表达式为K=________;过量的SO2与NaOH溶液反应的化学方程式为
_____________________________________________________________。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是________、________。
(3)通氯气氧化时,发生的主要反应的离子方程式为____________;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为________(写化学式)。
(1) SO2+NaOH=NaHSO3
SO2+NaOH=NaHSO3
(2)提高铁元素的浸出率 抑制Fe3+水解
(3)Cl2+2Fe2+=2Cl-+2Fe3+ Cl2、HCl
【解析】(1)化学平衡常数为生成物的浓度幂之积与反应物的浓度幂之积的比,故该反应的K= ;过量二氧化硫与NaOH溶液反应生成亚硫酸氢钠:NaOH+SO2=NaHSO3;(2)酸溶时保持盐酸过量是为了使铁的化合物充分溶解,转化为离子,后续过程保持酸过量是为了抑制Fe3+水解;(3)氯气氧化亚铁离子生成三价铁离子和氯离子;(4)尾气中含未反应的氯气和挥发出HCl。
;过量二氧化硫与NaOH溶液反应生成亚硫酸氢钠:NaOH+SO2=NaHSO3;(2)酸溶时保持盐酸过量是为了使铁的化合物充分溶解,转化为离子,后续过程保持酸过量是为了抑制Fe3+水解;(3)氯气氧化亚铁离子生成三价铁离子和氯离子;(4)尾气中含未反应的氯气和挥发出HCl。

练习册系列答案
相关题目