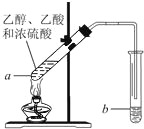
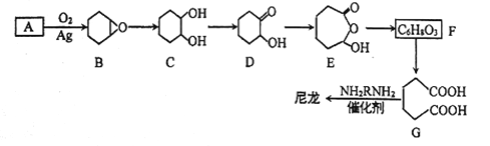
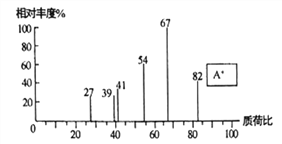
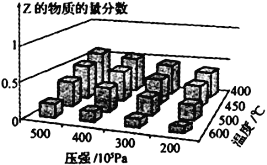
题目内容
【题目】A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期。B元素原子含有3个能级,且毎个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子。请回答下列问题:
(1)写出C基态原子的价层电子排布____________,F基态原子的外围电子排布式_____________。
(2)下列说法不正确的是____________ (填序号)。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2 > CO2
B.笫一电离能由小到大的顺序:B <C < D
C.N2与CO为等电子体,结构相似
D.稳定性:H2O> H2S,水分子更稳定的原因是水分子间存在氢键
(3)F元素位于周期表中_________区,其离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通人过量的C与A形成的气体X可生成[F(X)4]2+,该离子的结构式为__________(用元素符号表示)。
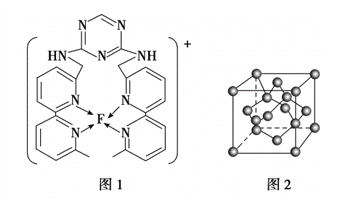
(4)某化合物与F(I)(I表示化合价为+ 1)结合形成下图1所示的离子,该离子中碳原子的杂化方式为________________________________。
(5)B单质的一种同素异形体的晶胞如下图2所示,则一个晶胞中所含B原子的个数为____________。
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为apm, F离子的半径bpm,则该晶胞的空间利用率为_______________。
【答案】 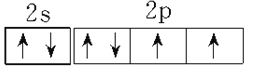 3d104s1 ABD ds
3d104s1 ABD ds 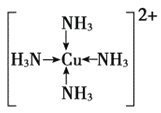 sp2、sp3 8 (2πa3+2πb3)/3(a+b)3×100%。
sp2、sp3 8 (2πa3+2πb3)/3(a+b)3×100%。
【解析】根据题给信息进行分析可知:A 为H,B为C,C为N,D为O,E为Fe ,F为 Cu;
(1)C为N,基态N原子的价层电子排布2s22p3,其价电子排布图为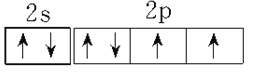 ;F为 Cu, Cu基态原子的外围电子排布式3d104s1。正确答案:
;F为 Cu, Cu基态原子的外围电子排布式3d104s1。正确答案: ;3d104s1。
;3d104s1。
(2)二氧化硅为原子晶体,而二氧化碳为分子晶体,所以沸点:SiO2 > CO2,A错误;B为C,C为N,D为O,第一电离能第VA族元素大于相邻的主族元素,所以笫一电离能由小到大的顺序:N>O>C;B错误;N2与CO原子数目相同,价电子数目相同,二者为等电子体,结构相似,C正确;稳定性:H2O> H2S,是因为非金属性O> S,与分子间存在氢键无关,D错误;正确选项ABD。
(3)F为 Cu,位于周期表中ds区,向硫酸铜溶液中通人过量的C与A形成的气体氨气可生成[Cu(NH4)4]2+,该离子的结构式为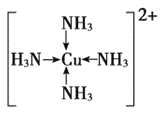 ;正确答案:ds;
;正确答案:ds; 。
。
(4)杂环上的碳原子含有3个σ键,没有孤对电子,采用sp2杂化,亚甲基上碳原子含有4个共价单键,采用sp3杂化;正确答案:sp2;sp3。
(5)B原子有4个位于晶胞内部,其余B原子位于顶点、面心,则一个晶胞中所含有B原子数为4+8×1/8+6×1/2=8;正确答案:
(6)D为O, F为 Cu;D与F形成离子个数比为1:1的化合物CuO,晶胞与氯化钠相似,晶胞中铜离子数目=阳离子数目=8×1/8+6×1/2=4, O2-离子的半径为apm, Cu2+离子的半径bpm,则晶胞中原子总体积为4×(4/3×πa3+4/3×πb3),晶胞棱长为2(a+b)pm,所以晶胞的体积为8(a+b)3,该晶胞的空间利用率为4×(4/3×πa3+4/3×πb3)÷8(a+b)3×100%=(2πa3+2πb3)/3(a+b)3×100%;正确答案:(2πa3+2πb3)/3((a+b)3×100%。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案