题目内容
19.有机物 与足量NaOH水溶液在加热条件下反应的化学方程式为
与足量NaOH水溶液在加热条件下反应的化学方程式为 .
.
分析  含有酚羟基,可与氢氧化钠发生中和反应,含有氯原子,可水解生成醇,以此解答.
含有酚羟基,可与氢氧化钠发生中和反应,含有氯原子,可水解生成醇,以此解答.
解答 解: 含有酚羟基,可与氢氧化钠发生中和反应,含有氯原子,可水解生成醇,反应的化学方程式为
含有酚羟基,可与氢氧化钠发生中和反应,含有氯原子,可水解生成醇,反应的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质,为解答该题的关键,难度不大.

练习册系列答案
相关题目
9.锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
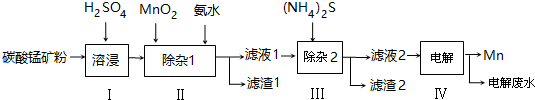
已知25℃,部分物质的溶度积常数如下:
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是:升高温度、适当增大硫酸浓度、减小矿粉颗粒直径.(至少答两条)
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为Fe(OH)3(填化学式).已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2OFe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+.
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失.
(4)滤液2中,c(Co2+):c(Ni2+)=5:1.
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg.若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为$\frac{(b-\frac{c}{107}×\frac{1}{2}×55)×\frac{115}{55}}{a}$×100%.(用含a、b、c的式子表达,无需化简)

已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为Fe(OH)3(填化学式).已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2OFe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+.
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失.
(4)滤液2中,c(Co2+):c(Ni2+)=5:1.
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg.若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为$\frac{(b-\frac{c}{107}×\frac{1}{2}×55)×\frac{115}{55}}{a}$×100%.(用含a、b、c的式子表达,无需化简)
10.下列叙述正确的是( )
| A. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 | |
| B. | 只要含有金属阴离子的晶体就一定是离子晶体 | |
| C. | 第三周期元素的离子半径从左到右逐渐减小 | |
| D. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
4.加热试管中的NH4HCO3,使放出的气体依次通过盛有足量过氧化钠的干燥管、足量浓硫酸的洗气瓶,最后得到的气体是( )
| A. | NH3 | B. | O2 | C. | H2O | D. | CO2 |
11.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的( )
| A. | SiO2和 SO2 | B. | CO2和 H2O | C. | NaCl 和 HCl | D. | CCl4和 KCl |
8.石墨烯可看作将石墨的层状结构一层一层地剥开得到的单层碳原子;石墨炔是平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能,还可用于H2的提纯;将氢气氢化到石墨烯排列的六角晶格中,使每个碳原子都增加一个氢原子可得最薄的绝缘新材料石墨烷.下列有关说法中不正确的是( )
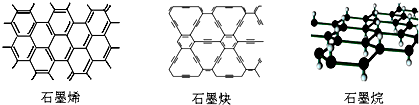

| A. | 石墨烯和石墨炔互为同素异形体 | |
| B. | 石墨炔有望替代二氧化硅用作半导体材料 | |
| C. | 12g石墨烯完全转变为石墨烷需标况下11.2L氢气 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
9.2008年奥运会在北京举行时用大型遥控飞艇作为宣传工具以渲染活动气氛,为了使飞艇在空中安全而有效,你认为飞艇内充入哪种气体最好( )
| A. | 氢气 | B. | 氦气 | C. | 氧气 | D. | 二氧化碳 |
 ;E的离子结构示意图
;E的离子结构示意图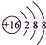 .
.