题目内容
下列物质的工业生产原理,不符合实际的是( )
A、工业制备金属钠:2NaCl
| ||||
B、工业制备金属镁:MgCl2
| ||||
C、工业制备氯气和烧碱:2NaCl+2H2O
| ||||
D、工业制备金属铝:2AlCl3
|
分析:A、金属钠是活泼金属,工业上采用电解熔融物的方法冶炼;
B、金属镁是活泼金属,工业上采用电解熔融物的方法冶炼;
C、工业上电解饱和食盐水获得烧碱、氢气和氯气;
D、金属铝是活泼金属,工业上采用电解熔融物的方法冶炼.
B、金属镁是活泼金属,工业上采用电解熔融物的方法冶炼;
C、工业上电解饱和食盐水获得烧碱、氢气和氯气;
D、金属铝是活泼金属,工业上采用电解熔融物的方法冶炼.
解答:解:A、金属钠是活泼金属,工业上采用电解熔融氯化钠的方法冶炼,即2NaCl
2Na+Cl2↑,故A正确;
B、金属镁是活泼金属,工业上采用电解熔融氯化镁的方法冶炼,即MgCl2
Mg+Cl2↑,故B正确;
C、工业上电解饱和食盐水获得烧碱、氢气和氯气,原理方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故C正确;
D、金属铝是活泼金属,工业上采用电解熔融氧化铝的方法冶炼,氯化铝是共价化合物,不能电解氯化铝得到金属铝,故D错误.
故选D.
| ||
B、金属镁是活泼金属,工业上采用电解熔融氯化镁的方法冶炼,即MgCl2
| ||
C、工业上电解饱和食盐水获得烧碱、氢气和氯气,原理方程式为:2NaCl+2H2O
| ||
D、金属铝是活泼金属,工业上采用电解熔融氧化铝的方法冶炼,氯化铝是共价化合物,不能电解氯化铝得到金属铝,故D错误.
故选D.
点评:本题涉及金属的冶炼方法以及氯碱工业知识,注意知识的归纳和整理,较简单.

练习册系列答案
相关题目

 2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。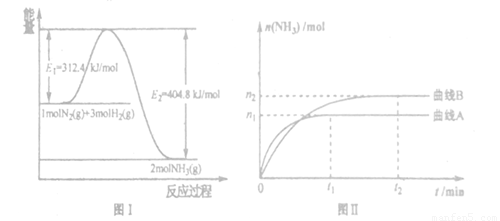
 mol/(L·min)
mol/(L·min) 倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______