题目内容
【题目】Ⅰ.CO可用于合成甲醇。在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
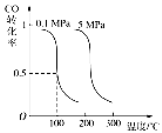
(1)该反应属于 反应(填“吸热”或“放热”)。
(2)100℃时,该反应的平衡常数:K= (用a、b 的代数式表示)。
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO,2a mol H2,达到平衡时CO转化率
(填“增大”“不变”或“减小”)
Ⅱ.T ℃时,纯水中c(OH-)为10-6 mol·L-1,则该温度时
(1)将pH=3 的H2SO4溶液与pH=10的NaOH溶液按体积比9:2 混合,所得混合溶液的pH为 。
(2)若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
Ⅲ. 在25mL的氢氧化钠溶液中逐滴加入0. 2 mol/ L醋酸溶液,滴定曲线如图所示。
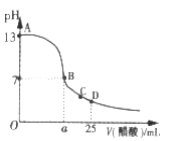
(1)该氢氧化钠溶液浓度为________________。
(2)在B点,a_________12.5 mL(填“<”“>”或“=”)。
(3)在D点,溶液中离子浓度大小关系为_____________________。
【答案】Ⅰ.(1)放热;(2)![]() (3)增大;
(3)增大;
Ⅱ.(1)9 (2)a+b=11或pH1+pH2=11
Ⅲ.(1)0.1 (2) > (3) c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
【解析】
试题分析:Ⅰ.(1)由图可知,压强一定时,随温度升高,CO的转化率降低,故升高温度平衡向逆反应移动,则正反应为放热反应;
(2)100℃,平衡时CO的转化率为0.5,所以参加反应的CO的物质的量为0.5amol.
CO(g)+2H2(g)![]() CH3OH(g);
CH3OH(g);
开始(mol):a 2a 0
变化(mol):0.5a a 0.5a
平衡(mol):0.5a a 0.5a
所以平衡时,CO的浓度为![]() =
=![]() mol/L,H2的浓度为=mol/L,CH3OH的浓度为
mol/L,H2的浓度为=mol/L,CH3OH的浓度为![]() =
=![]() mol/L,100℃时该反应的平衡常数k=
mol/L,100℃时该反应的平衡常数k=![]() ;
;
(3)在温度和容积不变的情况下,再向平衡体系中充入amolCO(g)、2amol H2(g),等效为在原平衡的基础上增大一倍压强,平衡向正反应移动,CO的转化率增大。
Ⅱ.(1)T℃时,纯水中c(OH-)为10-6molL-1,则c(H+)=c(OH-)=10-6molL-1,离子积常数Kw=10-12,pH=3的硫酸溶液中c(H+)=10-3 mol/L,pH=10的NaOH溶液中c(OH-)=![]() mol/L=0.01mol/L,混合溶液中c(OH-)=
mol/L=0.01mol/L,混合溶液中c(OH-)=![]() =0.001mol/L,c(H+)=
=0.001mol/L,c(H+)=![]() mol/L=10-9mol/L,pH=-lgc(H+)=-lg10-9=9;
mol/L=10-9mol/L,pH=-lgc(H+)=-lg10-9=9;
(2)若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,说明酸中n(H+)等于碱中n(OH-),即存在10-a×1=10×10b-12,则a+b=11;
Ⅲ.(1)未滴加醋酸时溶液的pH=13,NaOH是强电解质,则c(NaOH)=c(OH-)=![]() =
=![]() mol/L=0.1mol/L;
mol/L=0.1mol/L;
(2)醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使混合溶液呈中性,则醋酸应该稍微过量,所以a>12.5mL;
(3)D点时溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,醋酸电离程度大于醋酸根离子水解程度导致溶液呈酸性,醋酸电离程度较小,所以溶液中离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案

