题目内容
【题目】有50mlNaOH溶液,向其中逐渐加入一定量的CO2,随后取此溶液10ml将其稀释至100ml,并向此稀释后的溶液中逐滴加入0.1mol·L-1的HCl溶液,产生CO2气体的体积(标准状况)与所加入盐酸的体积之间的关系如下图所示:

(1)甲溶液中的溶质是 ,其物质的量之比为 。
(2)乙溶液中的溶质是 ,其物质的量之比为 。
(3)原NaOH溶液的物质的量浓度为 。
【答案】
(1)NaOH、Na2CO3;1:1;
(2)Na2CO3、NaHCO3;1:1;
(3)0.75mol/L
【解析】
试题分析:当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑。
(1)(甲)中生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH + HCl = NaCl + H2O , 溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=25mL:25mL=1:1;故答案为:NaOH 、Na2CO3 ,1:1 ;
(2)(乙)中生成CO2气体至最大,消耗HCl为50mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3 + HCl = NaHCO3 + NaCl可知,将CO32-转化为HCO3-应消耗HCl为50mL,而图象中开始生成CO2气体时消耗HCl体积为25mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3,Na2CO3转化为NaHCO3消耗盐酸体积为25mL,则原溶液中NaHCO3消耗盐酸体积50mL-25mL=25mol,故NaHCO3、Na2CO3的物质的量之比=25mL:25mL=1:1,故答案为:NaHCO3、Na2CO3,1:1;
(3)加入75mL盐酸时,溶液中溶质都恰好完全反应,此时溶液为NaCl溶液,根据守恒可知10mL溶液中n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=0.0075mol,故原氢氧化钠溶液的浓度=![]() =0.75mol/L,故答案为:0.75mol/L。
=0.75mol/L,故答案为:0.75mol/L。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:
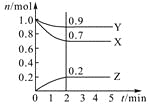
(1)该反应的化学方程式为 。
(2)反应开始至2 min,用Y表示的平均反应速率为 ,X的转化率为 。
(3)在一定温度下,下列情况可作为上述反应达到反应限度的标志的是 。
A.X、Y、Z的浓度相等 |
B.X、Y、Z的分子数比为3︰1︰2 |
C.Z的生成速率是Y的生成速率的二倍 |
D.单位时间内生成n mol Y,同时生成3n mol X |
(4)在密闭容器里,通入a mol A(g)和b mol B(g),
发生反应A(g)+ B(g)= 2C(g),当改变下列条件时,会加快反应速率的是 (填序号)。
①降低温度
②保持容器的体积不变,充入氦气
③加入催化剂
④保持容器的体积不变,增加A(g)的物质的量


