题目内容
【题目】氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________________________________
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式
___________________________________________________________________
有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之(已知Cu2O+2H+==Cu+Cu2++H2O)___________________________________________________________
(5)甲与乙之间_______(填“可能”或“不可能)发生反应产生H2,判断理由是_______
【答案】 AlH3 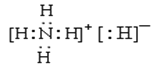 2AlH3+6H2O==2Al(OH)3+6H2↑ Mg3N2 2NH4H+5CuO
2AlH3+6H2O==2Al(OH)3+6H2↑ Mg3N2 2NH4H+5CuO![]() 5Cu+ N2↑+5H2O 取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O 可能 AlH3中氢元素的化合价为-1价,NH4H中含有+1价的氢元素,二者可发生氧化还原反应产生H2
5Cu+ N2↑+5H2O 取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O 可能 AlH3中氢元素的化合价为-1价,NH4H中含有+1价的氢元素,二者可发生氧化还原反应产生H2
【解析】白色沉淀可溶于NaOH溶液,应为Al(OH)3 ,说明甲中含有Al和H两种元素,n(H2)=![]() ==0.3mol,则m(H)=0.3mol×2×1g·mol-1=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=
==0.3mol,则m(H)=0.3mol×2×1g·mol-1=0.6g,则6.00g甲中含有m(Al)=6.00g-0.6g=5.4g,n(Al)=![]() ==0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3,丙在标准状况下的密度为1.25g·L-1,则丙的相对原子质量为1.25g·L-1×22.4L=28,应为N2,则乙为NH4H,(1)由以上分析可知甲为AlH3,乙为NH4H,电子式为
==0.2mol,所以n(Al):n(H)=0.2mol:0.6mol=1:3,则甲的化学式为AlH3,丙在标准状况下的密度为1.25g·L-1,则丙的相对原子质量为1.25g·L-1×22.4L=28,应为N2,则乙为NH4H,(1)由以上分析可知甲为AlH3,乙为NH4H,电子式为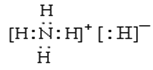 ;(2)AlH3与水发生氧化还原反应,化学方程式是2AlH3+6H2O==2Al(OH)3+6H2↑;(3)气体丙为N2与金属镁反应的产物是Mg3N2 ;(4)NH4H在加热条件下与CuO反应可生成Cu和气体N2,反应的方程式为2NH4H+5CuO
;(2)AlH3与水发生氧化还原反应,化学方程式是2AlH3+6H2O==2Al(OH)3+6H2↑;(3)气体丙为N2与金属镁反应的产物是Mg3N2 ;(4)NH4H在加热条件下与CuO反应可生成Cu和气体N2,反应的方程式为2NH4H+5CuO![]() 5Cu+ N2↑+5H2O,要判断产物中是否含有CuO,可加入稀硫酸检验溶液是否变蓝,方法是取样后加H2SO4溶液,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O;(5)甲与乙之间可能发生反应产生H2,判断理由是:AlH3中氢元素的化合价为-1价,NH4H中含有+1价的氢元素,二者可发生氧化还原反应产生H2。
5Cu+ N2↑+5H2O,要判断产物中是否含有CuO,可加入稀硫酸检验溶液是否变蓝,方法是取样后加H2SO4溶液,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O;(5)甲与乙之间可能发生反应产生H2,判断理由是:AlH3中氢元素的化合价为-1价,NH4H中含有+1价的氢元素,二者可发生氧化还原反应产生H2。

【题目】某同学完成如下探究实验:
实验目的:比较Cl2、Br2、I2三种单质的氧化性强弱
实验药品:NaBr溶液、KI溶液、氯水、淀粉溶液
实验记录:
实验步骤 | 实验现象 | 实验结论 |
| 溶液变为橙黄色 | Ⅰ________ |
| 溶液变为黄色 | 氧化性:Br2>I2 |
| Ⅱ___________ |
反思与评价:
(1)Ⅰ________;Ⅱ________。
(2)步骤①反应的离子方程式为:________。
(3)检验②中所得黄色溶液含I2的另一种方法是(简述实验操作和相应的实验现象)________。
(4)你认为上述实转设计(填“能”或“不能)____达到实验目的,理由是_______。



